Variabilidad del acervo génico y parámetros germinativos en poblaciones naturales de Enterolobium contortisiliquum (Leguminosae) del Noreste Argentino
DOI:
https://doi.org/10.31055/1851.2372.v57.n4.38230Palabras clave:
Donantes de polen, estructura genética, germinación, microsatélites, timbó, variabilidad genéticaResumen
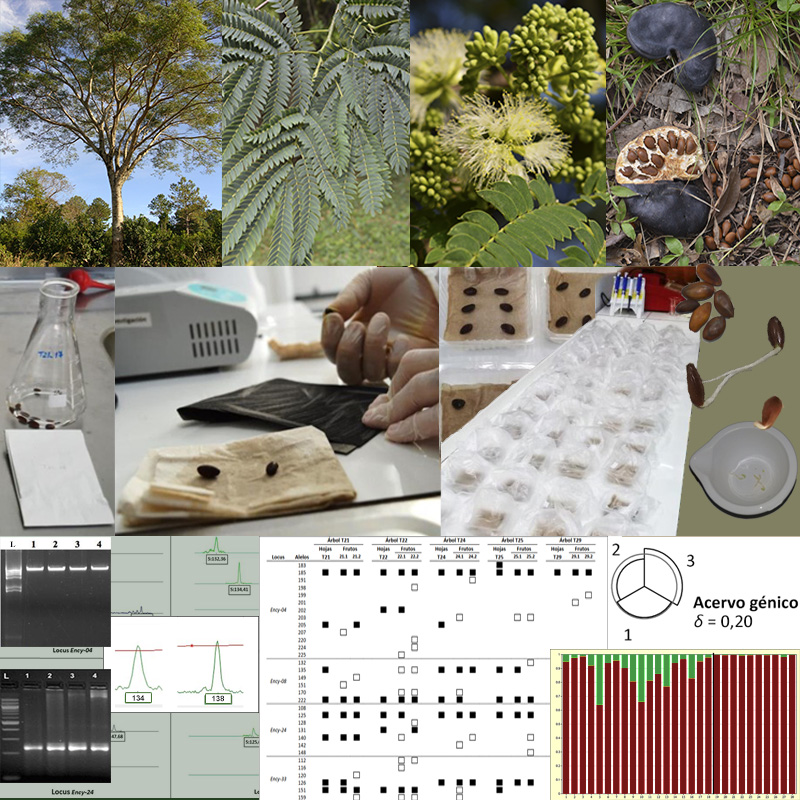
Introducción y objetivos: Enterolobium contortisiliquum constituye un recurso forestal nativo sudamericano. En el presente trabajo se estimó la variabilidad del acervo génico y se evaluaron variables germinativas en poblaciones del Noreste argentino de esta especie para analizar la relación entre el flujo génico, el sistema de fecundación y la dispersión.
M&M: Se genotipificaron individuos de las poblaciones Eldorado e Ituzaingó y semillas de Ituzaingó mediante cinco y cuatro loci microsatélites nucleares, respectivamente. Se determinaron variables germinativas, se caracterizó la diversidad genética y la estructura genética poblacional, se estimaron los niveles de flujo génico de manera indirecta, se identificó la presencia de alelos heredados vía polen y se determinó la representatividad de la variabilidad genética nuclear a nivel de locus y de acervo génico.
Resultados: Las poblaciones analizadas presentaron elevada diversidad genética. Se detectó el aporte, como mínimo, de uno o dos árboles donantes de polen por fruto y ausencia de estructura genética poblacional como consecuencia de elevados niveles de flujo génico mediado por polen y semillas. Las semillas presentaron la mayor diferenciación respecto a su complemento tanto a nivel de locus como de acervo génico.
Conclusiones: Los elevados niveles de flujo génico detectados contribuyen al mantenimiento de la variabilidad del acervo génico mientras que, la detección de elevados niveles de diversidad genética, valores nulos del coeficiente de endogamia, ausencia de estructura genética y alelos heredados vía polen a partir de una fuente externa a las poblaciones estudiadas respalda que la alogamia es el sistema de fecundación dominante en ellas.
Referencias
ABRAHAM DE NOIR, F., S. BRAVO & R. ABDALA. 2002. Mecanismos de dispersión de algunas especies de leñosas nativas del chaco occidental y serrano. Quebracho 9: 140-150.
ALEXANDRE, R. S., F. G. GONÇALVES, A. P. ROCHA, M. P. DE ARRUDA, & E. DE QUEIROZ LEMES. 2009. Tratamentos físicos e químicos na superação de dormência em sementes de Enterolobium contortisiliquum (Vell.) Morong. Rev. Bras. Cienc. Agrar. 4: 156-159. https://doi.org/10.5039/agraria.v4i2a6
ANDRIANOELINA, O., B. FAVREAU, L. RAMAMONJISOA & J. M. BOUVET. 2009. Small effect of fragmentation on the genetic diversity of Dalbergia monticola, an endangered tree species of the eastern forest of Madagascar, detected by chloroplast and nuclear microsatellites. Ann. Bot. 104: 1231-1242. https://doi.org/10.1093/aob/mcp231
BALKENHOL, N., S. A. CUSHMAN, A. T. STORFER, L. P. WAITS. 2016. Landscape Genetics: Concepts, Methods, Applications. 1st ed. John Wiley and Sons Ltd, Chichester. https://doi.org/10.1002/9781118525258.ch01
BARRETTO, S. S. B. & R. A. FERREIRA. 2011. Morphological aspects of fruits, seeds and seedlings of the Leguminosae Mimosoideae species: Anadenanthera colubrina (Vellozo) Brenan and Enterolobium contortisiliquum (Vellozo) Morong. Rev. Bras. Sementes 33: 223-232. https://doi.org/10.1590/S0101-31222011000200004
BERJAK, P, & N. W. PAMMENTER. 2002. Orthodox and recalcitrant seeds. En VOZZO J. A. (ed.) Tropical tree seed manual, pp 137-147. DCUSDA Forest Service, Washington.
BREED, M. F., OTTEWELL, K. M., GARDNER, M. G., MARKLUND, M. H., DORMONTT, E. E., & A. J. LOWE. 2015. Mating patterns and pollinator mobility are critical traits in forest fragmentation genetics. Heredity 115(2): 108-114. https://doi.org/10.1038/hdy.2013.48
CABRERA, A. L. 1971. Fitogeografía de la república Argentina. Bol. Soc. Argent. Bot. 14: 1-42.
CABRERA, A. L. 1976. Regiones fitogeográficas argentinas. Enciclopedia argentina de agricultura y jardinería. 2da ed. ACME S.A.C.I., Buenos Aires.
CHEN, C., E. DURAND, F. FORBES & O. FRANÇOIS. 2007. Bayesian clustering algorithms ascertaining spatial population structure: a new computer program and a comparison study. Mol. Ecol. Notes 7: 747-756. https://doi.org/10.1111/j.1471-8286.2007.01769.x
CRUZ-SILVA, C. T. A., & A. P. M. ROSA. 2011. Tratamentos para superação da dormência em sementes de orelha-de-negro (Enterolobium contortisiliquum (Vell.) Morong). Varia Sci. Agrár. 2(2): 79-90.
DURAND, E., C. CHEN & O. FRANÇOIS. 2009. TESS Version 2.3 Reference Manual. Disponible en: http://membres-timc.imag.fr/Olivier.Francois/tess.html [Acceso: 11 November 2022].
EXCOFFIER, L. & H. E. L. LISCHER. 2010. Arlequin suite ver 3.5: A new series of programs to perform population genetics analyses under Linux and Windows. Mol Ecol Resour. 10: 564-567. https://doi.org/10.1111/j.1755-0998.2010.02847.x
GENTRY, A. H. 1983. Dispersal ecology and diversity in neotropical forest communities. En K. KUBITZKI (ed.). Dispersal and Distribution: An International Symposium, pp. 303-314. Verlag Paul Parey, Berlin.
GILLET, E. 2010. GSED Genetic Structures from Electrophoresis Version 3.0 Data User’s Manual. Abt. Forstgenetik und Forstpflanzenzüchtung, Universität Göttingen, Göttingen.
GILLET, E., D. GÖMÖRY & L. PAULE. 2005. Measuring genetic variation within and among populations at marker loci. En GEBUREK, T. & J. TUROK (eds.) Conservation and Management of forest genetic resource in Europe, pp 237–270. Arbora Publishers, Zvolen.
GODOY, J. A. & P. JORDANO. 2001. Seed dispersal by animals: exact identification of source trees with endocarp DNA microsatellites. Mol. Ecol. 10: 2275-2283. https://doi.org/10.1046/j.0962-1083.2001.01342.x
GONCALVES, A. L., M. E. BARRANDEGUY & M. V. GARCÍA. 2013. Método económico de genotipificación por fluorescencia de SSRs en Anadenanthera colubrina var. cebil. Actas del XLII Congreso Argentino de Genética. BAG, J. basic appl. genet. 24(1): 107.
GONCALVES, A. L., M. V. GARCÍA, M. E. BARRANDEGUY, S. C. GONZÁLEZ-MARTÍNEZ & M. HEUERTZ. 2022. Spatial genetic structure and mating system in forest tree populations from seasonally dry tropical forests: a review. Tree Genet. Genomes 18: 1-16. https://doi.org/10.1007/s11295-022-01550-1
GREGORIUS, H. R. & J. H. ROBERDS. 1986. Measurement of genetical differentiation among subpopulations. Theor. Appl. Genet. 71: 826-834. https://doi.org/10.1007/BF00276425
GREGORIUS, H. R. 1984. Measurement of genetic differentiation in plant populations. En GREGORIUS, H.R (ed.) Population Genetics in Forestry, pp. 276-285. Springer-Verlag, Berlín. https://doi.org/10.1007/978-3-642-48125-3_19
HARTL, D. L. & A. G. CLARK. 2007. Principles of population genetics. 4th ed. Sinauer Associates, Sunderland.
HATTEMER, H. H. 2005. On the appropriate size of forest genetic resources. En GEBUREK T, TUROK J (eds.) Conservation and Management of forest genetic resource in Europe, pp. 413-436. Arbora Publishers, Zvolen.
HOC, P. S. 2005. Inga MILL J. F. En: ANTON, A. M. & ZULOAGA F. O. (eds.) Flora Fanerogámica Argentina, fasc. 93, pp. 14-19. Córdoba: IMBIV (CONICET), Programa PROFLORA.
HOC, P. S., C. FLORES, E. LOZANO & A. ZAPATER. 2015. Preliminary studies on the reproductive biology of Enterolobium contortisiliquum. Res. Plant Biol. 5: 14-18.
HUNTER, R. J. 1989. Seed dispersal and germination of Enterolobium cyclocarpum (Jacq.) Griseb. (Leguminosae: Mimosoideae): Are megafauna necessary? J. Biogeogr. 16(4): 369-378. https://doi.org/10.2307/2845228
IMBERT, E. & F. LEFÈVRE. 2003. Dispersal and gene flow of Populus nigra (Salicaceae) along a dynamic river system. J. Ecol. 91(3): 447-456. https://doi.org/10.1046/j.1365-2745.2003.00772.x
LE CORRE, V. & A. KREMER. 1998. Cumulative effects of founding events during colonisation on genetic diversity and differentiation in an island and stepping‐stone model. J. Evol. Biol. 11: 495-512. https://doi.org/10.1046/j.1420-9101.1998.11040495.x
LOZANO, E. C., M. A. ZAPATER, C. MAMANI, C. B. FLORES, M. N. GIL & S. S. SÜHRING. 2016. Efecto de pretratamientos en semillas de Enterolobium contortisiliquum (Fabaceae) de la selva pedemontana argentina. Bol. Soc. Argent. Bot. 51(1): 79-87. https://doi.org/10.31055/1851.2372.v51.n1.14414
LOZANO‐ISLA, F., O. E. BENITES‐ALFARO & M. F. POMPELLI. 2019. GerminaR: An R package for germination analysis with the interactive web application “GerminaQuant for R”. Ecol. Res. 34: 339-346. https://doi.org/10.1111/1440-1703.1275
MANEL, S., M. K. SCHWARTZ, G. LUIKART & P. TABERLET. 2003. Landscape genetics: combining landscape ecology and population genetics. Trends Ecol. Evol. 18: 189-197. https://doi.org/10.1016/S0169-5347(03)00008-9
MOREIRA, P. A., S. A. S. SOUZA, E. A. OLIVEIRA, N. H. ARAÚJO, G. W. FERNANDES & D. A. OLIVIERA. 2012. Charaterization of nine tranferred SSR markers in the tropical tree species Enterolobium contortisiliquum (Fabaceae). Genet. Mol. Res. 11: 2338-2342. https://doi.org/10.4238/2012.August.17.11
MOREIRA, P., M. M. BRANDÃO, N. H. DE ARAUJO, D. A. DE OLIVEIRA & G. W. FERNANDES. 2015. Genetic diversity and structure of the tree Enterolobium contortisiliquum (Fabaceae) associated with remnants of a seasonally dry tropical forest. Flora 210: 40-46. https://doi.org/10.1016/j.flora.2014.10.005
MOREIRA, P.A, F. DE SIQUEIRA NEVES & J.A. LOBO. 2021. Consequences of tropical dry forest conversion on diaspore fate of Enterolobium contortisiliquum (Fabaceae). Plant Ecol. 222, 525–535. https://doi.org/10.1007/s11258-021-01124-6
MORELLO, J. & J. ADÁMOLI. 1974. Las grandes unidades de vegetación y ambiente del Chaco argentino. Parte II. Provincia del Chaco. Serie Fitogeográfica del INTA, Buenos Aires.
NEI, M. 1987. Genet. Sel. Evol. Columbia University Press, New York.
PEAKALL, R. & P.E. SMOUSE 2012. GenAlEx 6.5: genetic analysis in Excel. Population genetic software for teaching and research-an update. Bioinformatics 28: 2537-2539. https://doi.org/10.1093/bioinformatics/bts460
PETERS, M.B., C. HAGEN, D. W. TRAPNELL, J. L.HAMRICK, O. ROCHA, P. E. SMOUSE & T. C. GLENN. 2008. Isolation and characterization of microsatellite loci in the Guanacaste tree, Enterolobium cyclocarpum. Mol. Ecol. Resour. 8: 129-131. https://doi.org/10.1111/j.1471-8286.2007.01896.x
PRADO, D. E. 1993. What is the Gran Chaco vegetation in South America? II. A redefinition. Contribution to the study of flora and vegetation of the Chaco. VII. Candollea 48: 615-629. https://doi.org/10.1017/S096042860000041X
PRADO, D. E. 2000. Seasonally Dry Tropical Forest of tropical South America: From forgotten ecosystems to a new phytogeographic unit. Edinburgh J. Bot. 57(03): 437-461.
PRITCHARD, J. K., M. STEPHENS & P. DONNELLY. 2000. Inference of population structure using multilocus genotype data. Genetics 155: 945-959. https://doi.org/10.1093/genetics/155.2.945
ROCHA, O. J. & G. AGUILAR (2001a). Reproductive biology of the dry forest tree Enterolobium cyclocarpum (Guanacaste) in Costa Rica: a comparison between trees left in pastures and trees in continuous forest. Am. J. Bot. 88(9): 1607-1614. https://doi.org/10.2307/3558405
ROCHA, O. J. & G. AGUILAR. 2001b. Variation in the breeding behavior of the dry forest tree Enterolobium cyclocarpum (Guanacaste) in Costa Rica. Am. J. Bot. 88: 1600-1606. https://doi.org/10.2307/3558404
ROUSSET, F. 2008. Genepop’007: a complete re-implementation of the genepop software for Windows and Linux. Mol. Ecol. Resour. 8: 103-106. https://doi.org/10.1111/j.1471-8286.2007.01931.x
SALAZAR, R. 2000. Manejo de semillas de 100 especies forestales de América Latina. Proyecto de Semillas Forestales/Danida Forest Seed Centre. CATIE, Turrialba, Costa Rica.
SCHUELKE, M. 2000. An economic method for the fluorescent labeling of PCR fragments. Nat. Biotechnol. 18: 233. https://doi.org/10.1038/72708
SLATKIN, M. 1993. Isolation by distance in equilibrium and nonequilibrium populations. Evolution 47: 264–279. https://doi.org/10.1111/j.1558-5646.1993.tb01215.x
SORK, V. L., & SMOUSE, P. E. 2006. Genetic analysis of landscape connectivity in tree populations. Landsc. Ecol. 21: 821-836. https://doi.org/10.1007/s10980-005-5415-9
STEWART, C. N. & L. EXCOFFIER. 1996. Assessing population genetic structure and variability with RAPD data: Application to Vaccinium macrocarpa (American cranberry). J. Evol. Biol. 9: 153-171. https://doi.org/10.1046/j.1420-9101.1996.9020153.x
SZPIECH, Z.A., M. JAKOBSSON & N.A. ROSENBERG. 2008. ADZE: A rarefaction approach for counting alleles private to combinations of populations. Bioinformatics 24: 2498-2504. https://doi.org/10.1093/bioinformatics/btn478
TOMMASI, F., C. PACIOLLA & O. ARRIGONI. 1999. The ascorbate system in recalcitrant and orthodox seeds. Physiol. Plant. 105: 193-198. https://doi.org/10.1034/j.1399-3054.1999.105202.x
TORTORELLI, L.A. 2009. Maderas y bosques argentinos. Buenos Aires, Argentina. Orientación Gráfica Editora.
WRIGHT, S. 1965. The interpretation of population structure by F-statistics with special regard to systems of mating. Evolution 19: 395-420. https://doi.org/10.1111/j.1558-5646.1965.tb01731.x
Publicado
Número
Sección
Licencia
Derechos de autor 2022 Carla Gabriela Martinotto, María Eugenia Barrandeguy, Alejandra Lorena Goncalves, María Victoria García

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
El Bol. Soc. Argent. Bot.:
- Provee ACCESO ABIERTO y gratuito inmediato a su contenido bajo el principio de que hacer disponible gratuitamente la investigación al público, lo cual fomenta un mayor intercambio de conocimiento global.

- Permite a los autores mantener sus derechos de autor sin restricciones.
- El material publicado en Bol. Soc. Argent. Bot. se distribuye bajo una licencia de Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.






