Evaluación de los micromicetes asociados a la corteza de fresno en Buenos Aires (Argentina): su capacidad para degradar madera y tolerancia a metales pesados
DOI:
https://doi.org/10.31055/1851.2372.v57.n3.36749Palabras clave:
biomonitoreo, contaminación, fresno, micromicetesResumen
Introducción y objetivos: La contaminación ambiental podría afectar el estado sanitario del arbolado y a la biodiversidad de microorganismos. Fraxinus pennsylvanica es uno de los árboles más frecuentes en la Ciudad de Buenos Aires.
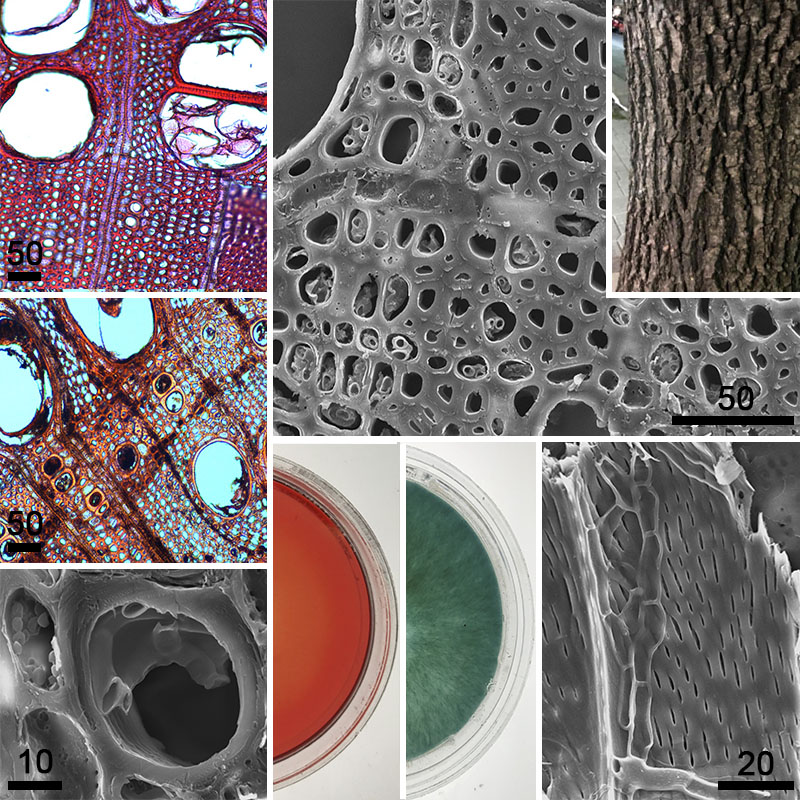
Los objetivos del trabajo fueron: relevar los micromicetes presentes en la corteza y madera de fresno, determinar si los micromicetes hallados con mayor frecuencia en la corteza producen enzimas lignocelulolíticas, describir los principales cambios anatómicos generados en la madera, y evaluar su tolerancia a metales pesados (Cu y Pb).
M&M: Se recolectaron trozos de corteza y madera en un gradiente urbano-periurbano en el AMBA. Se evaluó el deterioro causado in vitro en la madera por los micromicetes aislados con mayor frecuencia. Se determinó la pérdida de peso, se analizaron los cambios anatómicos. Se determinó la producción de enzimas lignocelulolíticas y tolerancia al Cu y Pb.
Resultados: Diplodia sp., Fusicoccum sp. y Sordaria sp. fueron los micromicetes detectados con mayor frecuencia en corteza, mientras que Alternaria sp., Diplodia sp. y Phialophora sp. se aislaron de madera. Ninguno causó síntomas de pudrición blanda, ni pérdidas importantes en el peso seco de la madera (3-5% luego de 6 meses), ni cambios microanatómicos. Se detectó actividad celulolítica en todos los micromicetes evaluados. Todos fueron capaces de crecer en 250 mg/Kg de Cu o 1000 mg/Kg de Pb.
Conclusiones: Los micromicetes presentes en la corteza no afectarían el estado sanitario del arbolado. Su tolerancia a altas concentraciones de metales pesados sugiere potencialidad como biomonitores de contaminación ambiental.
Referencias
ALATOU, H. & L. SAHLI. 2019. Using tree leaves and barks collected from contaminated and uncontaminated areas as indicators of air metallic pollution. Int. J. Phytoremediation. 21: 985-997. https://doi.org/10.1080/15226514.2019.1583723.
ARCHIBALD, F. S. 1992. A new assay for lignin-type peroxidases employing the dye azure B. Appl. Environ. Microbiol. 58: 3110-3116. https://doi.org/10.1128/aem.58.9.3110-3116.1992.
BALDRIAN, P. 2010. Effect of heavy metal on saprotrophic soil fungi. In: SHERAMETI, I. & A. VARMA (eds.). Soil Heavy Metals. Soil Biology. pp 263-279. Springer. Germany. https://doi.org/10.1007/978-3-642-02436-8_12.
BARENGO, N., T. N., SIEBER & O. HOLDENRIEDER. 2000. Diversity of endophytic mycobiota in leaves and twigs of pubescent birch (Betula pubescens). Sydowia. 52: 305-320.
CARDER, J. H. 1986. Detection and quantitation of cellulase by congo red staining of substrates in a cup-plate diffusion assay. Anal. Biochem. 153: 75-79. https://doi.org/10.1016/0003-2697(86)90063-1.
CARMICHAEL, J. W., W. BRYCE KENDRICK & I. L. CONNERS. 1980. Genera of Hyphomycetes. University of Alberta, Canada.
CARRERAS, H. A. & M. L. PIGNATA. 2002. Biomonitoring of heavy metals and air quality in Cordoba City, Argentina, using transplanted lichens. Environ. Pollut. 117: 77-87. https://doi.org/10.1016/S0269-7491(01)00164-6.
CASCIELLO, C., F. TONIN, F. FERINI, E. FASOLI, F. MARINELLI, L. POLLEGIONI & E. ROSINI. 2017. A valuable peroxidase activity from the novel species Nonomuraea gerenzanensis growing on alkali lignin. Biotechnol. Rep. 13. https://doi.org/10.1016/j.btre.2016.12.005.
CATANIA, M. V. 2021. Micromycetes on bark and wood of Podocarpus parlatorei (Podocarpaceae) from Argentina. X. Chaetosphaeria (Chaetosphaeriaceae, Ascomycota). Bonpladia 30: 107-118. http://dx.doi.org/10.30972/bon.3014670.
CATINON, M., S. AYRAULT, R. CLOCCHIATTI, O. BOUDOUMA, J. ASTA, M. TISSUT & P. RAVANEL. 2009. The anthropogenic atmospheric elements fraction: a new interpretation of elemental deposits on tree barks. Atmos. Environ. 43: 1124-1130. https://doi.org/10.1016/j.atmosenv.2008.11.004.
CATINON, M., S. AYRAULT, O. BOUDOUMA, J. ASTA, M. TISSUT & P. RAVANEL. 2012. Atmospheric element deposit on tree barks: The opposite effects of rain and transpiration. Ecol. Indic. 14: 170-177. https://doi.org/10.1016/j.ecolind.2011.07.013.
CHRABĄSZCZ, M. & L. MRÓZ. 2017. Tree bark, a valuable source of information on air quality. Pol. J. Envirom Stud. 26: 453-466. https://doi.org/10.15244/pjoes/65908.
CORDERO, R. J. & A. CASADEVALL. 2017. Functions of fungal melanin beyond virulence. Fungal Biol. Rev. 31: 99-112. https://doi.org/10.1016/j.fbr.2016.12.003.
CRAGG, S. M., G. T. BECKHAM, N. C. BRUCE, T. D. H. BUGG, D. L. DISTEL, P. DUPREE, A. G. ETXABE, B. S. GOODELL, J. JELLISON, J. E. Mc GEEHAN, S. J. Mc QUEEN-MASON, K. SCHNORR, P. H. WALTON, J. E. M. WATTS & M. ZIMMER. 2015. Lignocellulose degradation mechanisms across the Tree of Life. Curr. Opin. Chem. Biol. 29: 108-119. https://doi.org/10.1016/j.cbpa.2015.10.018.
CUNY, D., C. VAN HALUWYN & R. PESCH. 2001. Biomonitoring of trace elements in air and soil compartments along the major motorway in France. Water Air Soil Pollut. 125: 273-290. https://doi.org/10.1023/A:1005278900969
DENNIS, R. W. G. 1981. British Ascomycetes. Strauss & Cramer, Germany.
DI RIENZO, J. A., F. CASANOVES, M. G. BALZARINI, L. GONZALEZ, M. TABLADA & C. W. ROBLEDO. 2020. InfoStat. Centro de Transferencia InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. Disponible en: http://www.infostat.com.ar.
EL-KHATIB, A. A., N. A. BARAKAT, N. A. YOUSSEF & N. A. SAMIR. 2020. Bioaccumulation of heavy metals air pollutants by urban trees. Int. J. Phytoremediation. 22: 210-222. https://doi.org/10.1080/15226514.2019.1652883.
ESTEVES, A. C., M. SARAIVA, A. CORREIA & A. ALVES. 2014. Botryosphaeriales fungi produce extracellular enzymes with biotechnological potential. Can. J. Microbiol. 60: 332-342. https://doi.org/10.1139/cjm-2014-0134.
EVERT, R. F. 2006. Esau′s Plant Anatomy. Meristems, cells, and tissues of the plant body. 3rd Ed. Willey, Canada. https://doi.org/10.1002/0470047380.
FERNANDES, L. P., C. J. ULHOA, E. R. ASQUIERI & V. NEVES MONTEIRO. 2007. Produção de amilases pelo fungo Macrophomina phaseolina. Revista Eletrônica de Farmácia 4: 43-51. https://doi.org/10.5216/ref.v4i1.2120.
FILIPPINI, L. M., L. BUSTILLO, H. P. MORUZZI, G. INOMATA, J. A. FLORENTINO & M. A. LAUDANI. 2000. El arbolado de la Ciudad de Buenos Aires: situación y estado actual, metodología para su estudio, pautas para su manejo racional. Santísima Trinidad, Buenos Aires.
FINDLAY, W. P. K. 1967. Timber pests and diseases. Pergamon series of monographs on furniture and timber. Pergamon Press, United Kingdom. https://doi.org/10.1016/C2013-0-01899-3.
FOGARTY, R. V. & J. M. TOBIN. 1996. Fungal melanins and their interactions with metals. Enzyme Microb. Technol. 19: 311-317. https://doi.org/10.1016/0141-0229(96)00002-6.
GLASS, N. L., M. SCHMOLL, J. H. D. CATE & S. CORADETTI. 2013. Plant cell wall deconstruction by ascomycete fungi. Annu. Rev. Microbiol. 67: 477-498. https://doi.org/10.1146/annurev-micro-092611-150044.
GRAMSS, G. 2017. Reappraising a controversy: Formation and role of the azodication (ABTS2+) in the laccase-ABTS catalyzed breakdown of lignin. Fermentation 3: 27. https://doi.org/10.3390/fermentation3020027.
HRYCAN, J., M. P. HARTBOWEN, T. FORGE & J. R. ÚRBEZ-TORRES. 2020. Grapevine trunk disease fungi: their roles as latent pathogens and stress factors that favour disease development and symptom expression. Phytopathol. Mediterr. 59: 395-424. https://doi.org/10.14601/Phyto-11275.
ISHFAQ, M., N. MAHMOOD, I. A. NASIR & M. SALEEM. 2017. Biochemical and molecular analysis of laccase enzyme in saprobic fungus Sordaria fimicola. Int. J. Agric. Biol. 19: 204-210. https://doi.org/10.17957/IJAB/15.0265.
ISKANDAR, N. L., N. A. I. M. ZAINUDIN & S. G. TAN. 2011. Tolerance and biosorption of copper (Cu) and lead (Pb) by filamentous fungi isolated from a freshwater ecosystem. J. Environ. Sci. 23: 824-830. https://doi.org/10.1016/S1001-0742(10)60475-5.
JANUSZ G., A. PAWLIK, J. SULEJ, U. ŚWIDERSKA-BUREK, A. JAROSZ-WILKOLAZKA & A. PASZCYŃSKY. 2017. Lignin degradation: microorganisms, enzymes involved, genomes analyses and evolution. FEMS Microbiol. Rev. 41: 941-962. https://doi.org/10.1093/femsre/fux049.
JOB, D. J. & J. E. WRIGHT. 1986. Experimental wood-rot of Salix humboldtiana blocks by species of Hymenochaete (Aphyllophorales). Mater. und Org. 21: 301-310.
KABATA-PENDIAS, A. 2011. Trace elements in soils and planta. 4th ed. CRC Press, USA.
KIMANI, V., R. ULLRICH, E. BÜTTNER, R. HERZOG, H. KELLNER, N. JEHMLICH, M. HOFRICHTER & C. LIERS. 2021. First dye-decolorizing peroxidase from an ascomycetous fungus secreted by Xylaria grammica. Biomolecules. 11. https://doi.org/10.3390/biom11091391.
KOWALSKI, T. & M. GAJOSEK. 1998. Endophytic mycobiota in stems and branches of Betula pendula to a different degree affected by air pollution. Austrian J. Mycol. 7: 13-24.
KUBICEK, C. P., T. L. STARR & N. L. GLASS. 2014. Plant cell wall–degrading enzymes and their secretion in plant-pathogenic fungi. Annual Rev. Phytopathol. 52: 427-451. https://doi.org/10.1146/annurev-phyto-102313-045831.
KUHAR, F., V. CASTIGLIA & L. LEVIN. 2015. Enhancement of laccase production and malachite green decolorization by co-culturing Ganoderma lucidum and Trametes versicolor in solid-state fermentation. International Biodeterior. Biodegrad. 104: 238-243. https://doi.org/10.1016/j.ibiod.2015.06.017.
KUMAR, A., A. K. CHATURVEDI, K. YADAV, K. P. ARUNKUMAR, S. K. MALYAN, P. RAJA & A. N. YADAV. 2019. Fungal phytoremediation of heavy metal-contaminated resources: current scenario and future prospects. In: YADAY, A., S. SINGH, S. MISHRA & A. GUPTA (eds). Recent Advancement in White Biotechnology through Fungi. pp. 437-461. Springer, Germany. https://doi.org/10.1007/978-3-030-25506-0_18.
LAKSHMI, K. M. S., P. S. SOUMYA, A. SHAJI & P. NAMBISAM. 2017. Lenzites elegans KSG32: a novel white rot fungus for synthetic dye decolourization. J. Bacteriol. Mycol: Open Access. 5: 311-317. https://doi.org/10.15406/jbmoa.2017.05.00138 .
LEPŠOVÁ, A. 1993. Applicability of fungi to the monitoring of environmental pollution by heavy metals. In: MARKERT, B. (ed.). Plants as Biomomitors. pp. 365-378. VCH, Germany. https://doi.org/10.13140/RG.2.2.16344.60165.
LEVIN L., L. VILLALBA, V. DA RE, F. FORCHIASSIN & L. PAPINUTTI. 2007. Comparative studies of loblolly pine biodegradation and enzyme production by Argentinean white rot fungi focused on biopulping processes. Process Biochem. 42: 995-1002. https://doi.org/10.1016/j.procbio.2007.03.008.
LIJTEROFF, R., L. LIMA & B. PRIERI. 2009. Uso de líquenes como bioindicadores de contaminación atmosférica en la ciudad de San Luis, Argentina. Rev. Int. Contam. Ambient. 25: 111-120.
LUO, Y., P. S. F. LICHTEMBERG, F. J. A. NIEDERHOLZER, D. M. LIGHTLE, D. G. FELTS & T. J. MICHAILIDES. 2019. Understanding the process of latent infection of canker-causing pathogens in stone fruit and nut crops in California. Plant Dis. 103: 2374-2384. https://doi.org/10.1094/PDIS-11-18-1963-RE.
MILIĆEVIĆ, T., M. A. UROŠEVIĆ, G. VUKOVIĆ, S. ŠKRIVANJ, D. RELIĆ, M. V. FRONTASYEVA & A. POPOVIĆ. 2017. Assessment of species-specific and temporal variations of major, trace and rare earth elements in vineyard ambient using moss bags. Ecotoxicol. Environ. Saf. 144: 208-215. https://doi.org/10.1016/j.ecoenv.2017.06.028.
MOREIRA, T. C., L. F. AMATO-LOURENCO, G. T. DA SILVA, C. D. SALDIVA DE ANDRÉ, P. A. ANDRE, L. V. BARROZO, J. M. SINGER, P. H. N. SALDIVA, M. SAIKI & G. M. LOCOSSELLI. 2018. The use of tree barks to monitor traffic related air pollution: a case study in São Paulo–Brazil. Front. Environ. Sci. 6: 1-12. https://doi.org/10.3389/fenvs.2018.00072.
NOBLES, M. K. 1965. Identification of culture of wood-inhabiting Hymenomycetes. Can. J. Bot. 43: 1097-1139. https://doi.org/10.1139/b65-126.
NOWROUSIAN, M., I. TEICHERT, S. MASLOFF & U. KÜCK. 2012. Whole-genome sequencing of Sordaria macrospora mutants identifies developmental genes. G3: Genes/ Genomes/ Genetics. 2: 261-270. https://doi.org/10.1534/g3.111.001479.
OLADIPO, O. G., O. O. AWOTOYE, A. OLAYINKA, C. C. BEZUIDENHOUT & M. S. MABOETA. 2018. Heavy metal tolerance traits of filamentous fungi isolated from gold and gemstone mining sites. Braz. J. Microbiol. 49: 29-37. https://doi.org/10.1016/j.bjm.2017.06.003.
PERELMAN, P., M. A. CASTRO, L. E. NAVARRO, M. RECHI, M. ARRIAGA, S. LÓPEZ, M. MARTÍNEZ CARRETERO & A. FAGGI. 2006. Análisis multielemental de cortezas de fresno (Fraxinus pennsylvanica) a lo largo de un gradiente urbano-periurbano en la metrópolis de Buenos Aires. Rev. Mus. Argent. Cienc. Nat. 8: 231-236. https://doi.org/10.22179/REVMACN.8.323.
PIGNATA, M. L., C. M. GONZALEZ, E. D. WANNAZ, H. A. CARRERAS, G. L. GUDIÑO & M. S. MARTINEZ. 2004. Biomonitoring of air quality employing in situ Ramalina celastri in Argentina. Int. J. Environ. Pollut. 22: 409-429. https://doi.org/10.1504/IJEP.2004.005678.
RISTA, L. M., R. MAUMARY, N. F. GARIGLIO & J. C. FAVARO. 2011. Botryosphaeria dothidea (Moug.) afectando plantaciones de manzano y duraznero de la región centro-este de Santa Fe. FAVE- Ciencia Agrarias 10: 45-52. https://doi.org/10.14409/FA.V10I1/2.4136.
ROBLES C. A. 2014. Biodeterioro fúngico de madera en el arbolado urbano: prospección, histopatología y control biológico en plátanos (Platanus acerifolia). Tesis Doctoral. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires.
SÁNCHEZ, R. M, C. C. CARMARÁN & M. V. BIANCHINOTTI 2018. Ostreichnion (Dothideomycetes, Ascomycota) en los bosques andino patagónicos (Argentina). Darwiniana 6: 47-57. https://www.jstor.org/stable/26852065.
SÁNCHEZ- FERNÁNDEZ R. E., B. L. SÁNCHEZ-ORTIZ, Y. K. M. SANDOVAL-ESPINOSA, Á. ULLOA-BENÍTEZ, B. ARMENDÁRIZ-GUILLÉN, M. C. GRACÍA-MÉNDEZ & M. L. MACÍAS-RUBALCAVA. 2013. Hongos endófitos: fuente potencial de metabolitos secundarios bioactivos con utilidad en agricultura y medicina. TIP 16: 132-146. https://doi.org/10.1016/S1405-888X(13)72084-9.
SCHWARZE, F. W. M. R, J. ENGELS & C. MATTHECK. 2000. Fungal Strategies of Wood Decay in Trees. Springer-Verlag, Germany.
SISTEMA NACIONAL DE VIGILANCIA Y MONITOREO DE PLAGAS [online]. Disponible en: https://www.sinavimo.gob.ar/plaga/botryosphaeria-dothidea. [Acceso: 23 diciembre 2021].
SIMPSON, E. H. 1949. Measurement of diversity. Nature 163: 688-688. https://doi.org/10.1038/163688a0.
SLIPPERS, B., W. A. SMIT, P. W. CROUS, T. A. COUTINHO, B. D. WINGFIELD & M. J. WINGFIELD. 2007. Taxonomy, phylogeny and identification of Botryosphaeriaceae associated with pome and stone fruit trees in South Africa and other regions of the world. Plant Pathol. 56: 128-139. https://doi.org/10.1111/j.1365-3059.2006.01486.x
SRINIVASAN, C., T. M. D’SOUZA, K. BOOMINATHAN & C. A. REDDY. 1995. Demonstration of laccase in the white rot basidiomycete Phanerochaete chrysosporium BKM-F1767. Appl. Environ. Microbiol. 61: 4274-4277. https://doi.org/10.1128/aem.61.12.4274-4277.1995.
STEFFEN, K. T., M. HOFRICHTER & A. HATAKKA. 2000. Mineralisation of 14C-labelled synthetic lignin and ligninolytic enzyme activities of litter-decomposing basidiomycetous fungi. Appl. Microbiol. Biotechnol. 54: 819-825. https://doi.org/10.1007/s002530000473
STEMPIEN E., M. L. GODDARD, K. WILHELM, C. TARNUS, C. BERTSCH & J. CHONG. 2017. Grapevine Botryosphaeria dieback fungi have specific aggressiveness factor repertory involved in wood decay and stilbene metabolization. PLoS ONE 12(12): e0188766. https://doi.org/10.1371/journal.pone.0188766.
SUTTON, B. C. 1980. The Coelomycetes. Fungi Imperfecti with Pycnidia, Acervulli and Stromata. CAB, United Kingdom.
ŚWISLOWSKI, P. & M. RAJFUR. 2018. Mushrooms as biomonitors of heavy metals contamination in forest areas. Ecol. Chem. Eng. S. 25: 557-568. https://doi.org/10.1515/eces-2018-0037.
ŚWISLOWSKI, P., J. KŘÍZ & M. RAJFUR. 2020. The use of bark in biomonitoring heavy metal pollution of forest areas on the example of selected areas in Poland. Ecol. Chem. Eng. S. 27: 195-210. https://doi.org/10.2478/eces-2020-0013.
TEICHERT, I., M. NOWROUSIAN, S. PÖGGELER & U. KÜCK. 2014. The filamentous fungus Sordaria macrospora as a genetic model to study fruiting body development. Adv. Genet. 87: 199-244. https://doi.org/10.1016/B978-0-12-800149-3.00004-4.
VON ARX, J. A. 1970. The Genera of Fungi Sporulating in Pure Culture. Verlag von Cramer, England.
WRIGHT, E. R., A. MANDOLESI, M. C. RIVERA & B. A. PÉREZ. 2010. Neofusicoccum parvum, blueberry pathogen in Argentina. XXVIII International Horticultural Congress on Science and Horticulture for People (IHC2010): International Symposium. 926: 619-623. https://doi.org/10.17660/ActaHortic.2012.926.89.
YANG, X., C. GU & Y. LIN. 2020. A novel fungal laccase from Sordaria macrospora k-hell: expression, characterization, and application for lignin degradation. Bioprocess Biosyst. Eng. 43: 1133-1139. https://doi.org/10.1007/s00449-020-02309-5.
ZARLAVSKY, G. E. 2014. Histología Vegetal: Técnicas Simples y Complejas. Sociedad Argentina de Botánica. Argentina.
Publicado
Número
Sección
Licencia
Derechos de autor 2022 Liliana Evelin Navarro, Laura Levin, Sonia Rosenfeldt

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
El Bol. Soc. Argent. Bot.:
- Provee ACCESO ABIERTO y gratuito inmediato a su contenido bajo el principio de que hacer disponible gratuitamente la investigación al público, lo cual fomenta un mayor intercambio de conocimiento global.

- Permite a los autores mantener sus derechos de autor sin restricciones.
- El material publicado en Bol. Soc. Argent. Bot. se distribuye bajo una licencia de Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.






