Artículos
originales
Seroprevalencia e infección por parvovirus humano B19 en embarazadas
de Córdoba, Argentina, 2021-2022
Seroprevalence
and infection by human parvovirus B19 in pregnant women from Córdoba,
Argentina, 2021-2022
Soroprevalência e infecção por parvovírus humano B19 em gestantes de
Córdoba, Argentina, 2021-2022
Néstor Dicuatro1, María Belén Colazo Salbetti2, Gabriel Amilcar Boggio3, Emilia Ortiz1, Mauro
Pedranti4, Nicolás Lionel Olivera5, Héctor Lucchini6, Alicia González7, Carlos
Resino7, Laura Moreno8, María Adamo9.
DATOS DE AUTORES
1. Universidad Nacional de Córdoba. Facultad de Ciencias Médicas.
Hospital Universitario de Maternidad y Neonatología. Servicio de Ginecología y
Obstetricia.
2. Universidad Nacional de Córdoba. Facultad de Ciencias Médicas. Instituto
de Virología “Dr. J. M. Vanella”. ORCID: https://orcid.org/0000-0002-5308-1102.
3. Universidad Nacional de Córdoba. Facultad de Ciencias Médicas.
Cátedra de Clínica Pediátrica. ORCID: https://orcid.org/0000-0001-9290-9307.
4. Universidad Nacional de Córdoba. Facultad de Ciencias Médicas. Instituto
de Virología “Dr. J. M. Vanella”.
ORCID: https://orcid.org/0000-0003-4884-1370.
5. Universidad Nacional de Córdoba. Facultad de Ciencias Médicas. Instituto
de Virología “Dr. J. M. Vanella”.
6. Universidad Nacional de Córdoba. Facultad de Ciencias Médicas.
Hospital Universitario de Maternidad y Neonatología. Cátedra de Clínica
Obstétrica y Perinatología.
7. Universidad Nacional de Córdoba. Facultad de Ciencias Médicas.
Hospital Universitario de Maternidad y Neonatología. Servicio de Neonatología.
8. Universidad Nacional de Córdoba. Facultad de Ciencias Médicas.
Cátedra de Clínica Pediátrica. ORCID: https://orcid.org/0000-0003-4006-2305.
9. Universidad Nacional de Córdoba. Facultad de Ciencias Médicas. Instituto
de Virología “Dr. J. M. Vanella”. ORCID: https://orcid.org/0000-0002-3639-3323. Correo de contacto: mpadamo@fcm.unc.edu.ar.
CONCEPTOS CLAVE:
Qué se sabe sobre el tema.
La
primoinfección por parvovirus B19 (B19V) durante el embarazo puede transmitirse
al feto y ocasionar complicaciones graves, incluyendo anemia, hidropesía y
muerte fetal. La evidencia de infección pasada (IgG) en ausencia de marcadores
de infección reciente se considera un factor protector de la transmisión
vertical. El principal grupo de riesgo es el de embarazadas en contacto
frecuente con población infantil. Determinar el estado inmune al inicio,
optimizar el abordaje diagnóstico y comprender la epidemiología de la infección
durante el embarazo contribuyen a la prevención y manejo de complicaciones
potencialmente graves por B19V.
Qué aporta este trabajo.
La
seroprevalencia (IgG) para B19V en embarazadas del Hospital Universitario de
Maternidad y Neonatología de Córdoba, Argentina, durante 2021-2022 fue 67,5%,
sin asociación con edad materna, multiparidad, exposición familiar a menores de
15 años ni presencia de signos/síntomas maternos/fetales. Se identificó la
infección por B19V en 10 casos sintomáticos (10,4%), todos ellos con anemia
materna y uno con hidropesía fetal y VDRL+. Los hallazgos revelan 32,5% de
susceptibles a contraer la infección en el futuro y la importancia de investigar
B19V en este grupo.
Divulgación
La infección por
parvovirus humano B19 durante la gestación puede transmitirse a través de la
placenta y en algunos casos ocasionar complicaciones fetales graves. La
presencia de anticuerpos IgG al inicio del embarazo se considera un factor
protector. Siendo frecuente la infección en niños, el principal grupo de riesgo
es el de embarazadas en contacto estrecho con población infantil. En este
estudio determinamos la prevalencia de IgG específica para B19 en embarazadas
de Córdoba, Argentina, durante 2021-2022, y analizamos su asociación con
factores predictores, incluyendo edad materna, convivencia con menores de 15
años y presencia de manifestaciones clínicas asociables a la infección. La
prevalencia fue 67,5%, sin asociación con los factores analizados. Entre los
casos con síntomas compatibles se identificó infección en 10,4%, todos ellos
con anemia materna y uno con hidropesía fetal. Los hallazgos revelan 32,5% de
susceptibles a contraer la infección en el futuro y la importancia de
investigar B19V ante la sospecha durante el embarazo.
Resumen
Introducción: la infección por parvovirus B19 (B19V) durante el
embarazo puede transmitirse al feto y ocasionar complicaciones graves como
hidropesía y muerte fetal. La preexistencia de IgG específica previene la
transmisión vertical. La seroprevalencia en edad fértil es variable (50-70%) y
depende de la región/circulación viral, además de factores como edad materna y
exposición frecuente a niños. Objetivos: determinar seroprevalencia para
B19V en embarazadas del Hospital Universitario de Maternidad y Neonatología
(HUMN), analizar su asociación con factores predictores y describir los casos
de infección por B19V. Métodos: estudio observacional, transversal. Se
incluyeron pacientes atendidas en HUMN durante 2021-2022 y se registraron datos
demográficos y clínicos compatibles. Se cuantificó IgG específica y se analizó
su asociación con factores predictores mediante análisis bivariado (p<0,05).
En los casos con signos/síntomas asociables a B19V se determinó además IgM
específica y ADN viral. Resultados: se estudiaron 317 casos y se detectó
IgG anti-B19V en 214/317 (67.5%). No se encontró asociación entre
seroprevalencia y edad materna, multiparidad, convivencia con menores de 15
años ni presencia de signos/síntomas maternos/fetales. Se identificaron 10
casos (10,4%) de infección por B19V, todos ellos con anemia y uno con
hidropesía fetal y VDRL+. Conclusión: en la población estudiada la
seroprevalencia para B19V fue 67,5% e independiente de los factores
predictores, restando 32,5% sin evidencia de exposición al virus (susceptible a
contraer la infección en el futuro). La detección de la infección en casos
sintomáticos indica la importancia de investigar B19V en este grupo.
Palabras clave:
virus B19; gestación;
seroprevalencia; hidropesía fetal; anemia.
Abstract
Introduction: parvovirus B19
(B19V) infection during pregnancy can be transmitted to the fetus and cause
serious complications such as fetal hydrops and stillbirth. The preexistence of
specific IgG prevents vertical transmission. Seroprevalence in fertile age is
variable (50-70%) and depends on the region/viral circulation, in addition to
factors such as maternal age and frequent exposure to children. Objectives:
to determine seroprevalence for B19V in pregnant women at Hospital
Universitario de Maternidad y Neonatología (HUMN), analyze its association with
predictive factors and describe cases of B19V infection. Methods:
observational, cross-sectional study. Patients treated at HUMN during 2021-2022
were included and compatible demographic and clinical data were recorded.
Specific IgG was quantified and its association with predictive factors was
analyzed by bivariate analysis (p<0.05). In cases with signs/symptoms
associated with B19V, specific IgM and viral DNA were also determined. Results:
317 cases were studied and anti-B19V IgG was detected in 214/317 (67.5%). No
association was found between seroprevalence and maternal age, multiparity,
cohabitation with children under 15 years of age, or presence of maternal/fetal
signs/symptoms. Ten cases (10.4%) of B19V infection were identified, all of
them with anemia and one with fetal hydrops and VDRL+. Conclusion: in
the population studied, B19V seroprevalence for was 67.5% and independent of
the predictive factors, leaving 32.5% without evidence of exposure to the virus
(susceptible to contracting the infection in the future). The detection of
infection in symptomatic cases indicates the importance of investigating B19V
in this group.
Keywords:
B19
virus; pregnancy; seroprevalence; fetal hydrops; anemia.
Resumo
Introdução: A infecção pelo parvovírus B19 (B19V) durante a
gravidez pode ser transmitida ao feto e causar complicações graves como
hidropisia e natimorto. A preexistência de IgG específica impede a transmissão
vertical. A soroprevalência na idade fértil é variável (50-70%) e depende da
região/circulação viral, além de fatores como idade materna e exposição
frequente dos filhos. Objetivos: determinar a soroprevalência para B19V
em gestantes do Hospital Universitário de Maternidade e Neonatologia (HUMN),
analisar sua associação com fatores preditivos e descrever casos de infecção
por B19V. Métodos: estudo observacional, transversal. Foram incluídos
pacientes atendidos no HUMN durante 2021-2022 e registrados dados demográficos
e clínicos compatíveis. A IgG específica foi quantificada e sua associação com
fatores preditivos foi analisada por análise bivariada (p<0,05). Nos casos
com sinais/sintomas associados ao B19V, também foram determinados IgM
específico e DNA viral. Resultados: Foram estudados 317 casos e IgG
anti-B19V foi detectado em 214/317 (67,5%). Não foi encontrada associação entre
soroprevalência e idade materna, multiparidade, coabitação com menores de 15
anos ou presença de sinais/sintomas maternos/fetais. Foram identificados dez
casos (10,4%) de infecção pelo B19V, todos com anemia e um com hidropisia fetal
e VDRL+. Conclusão: na população estudada a soroprevalência para B19V
foi de 67,5% e independente dos fatores preditivos, restando 32,5% sem
evidências de exposição ao vírus (susceptíveis de contrair a infecção no
futuro). A detecção da infecção em casos sintomáticos indica a importância da investigação
do B19V neste grupo.
Palavras-chave:
vírus
B19; gravidez; soroprevalência; hidropisia fetal; anemia.
Introducción
El parvovirus humano B19 (B19V) es el agente etiológico del eritema
infeccioso, también conocido como quinta enfermedad, en alusión a las
exantemáticas típicas de la niñez. El virus es endémico en todo el mundo. Sin
prevención por vacuna, la infección presenta un patrón estacional, con marcada
circulación desde fines de invierno a comienzos del verano en regiones de clima
templado y brotes de mayor magnitud durante períodos epidémicos, cada pocos
años(1,2). La primoinfección también puede ocurrir en pacientes
gestantes; en países europeos se ha estimado la incidencia de infección materna
en 0,6-2,4%(3,4). En los períodos epidémicos, la incidencia de la
infección durante el embarazo puede elevarse a 13,5%(5). En los
brotes (que pueden durar 3-6 meses), los
niños y sus contactos frecuentes (en el hogar, jardines maternales, escuela)
constituyen el grupo de mayor incidencia(6,7). La tasa de ataque
secundario (casos por número de susceptibles) se ha estimado en 50% en niños y
25% en maestras(8). Si la exposición es alta, 20-50% de las
mujeres susceptibles podrían adquirir la infección por B19V a partir de un contacto
infectado. Entre ellas, los grupos de riesgo incluyen madres de niños en edad
preescolar y escolar, trabajadoras de jardín maternal y maestras, por lo que se
ha sugerido considerar la determinación del estado inmune al inicio del
embarazo en estos grupos(9).
La inmunidad generada por la infección confiere protección de larga
duración y 50-70% de las mujeres en edad fértil tienen evidencia de infección
pasada (IgG), que en ausencia de marcadores de infección reciente se considera
un factor protector de la transmisión vertical(10). Cuando la
infección ocurre durante el embarazo, se reporta artralgia en aproximadamente
30% de los casos y exantema en hasta 40%. Estos síntomas son comunes y la
infección aguda por B19V a menudo puede pasarse por alto. Además, la presencia
de síntomas es breve y la mitad de los casos confirmados o más son
asintomáticos(11–14). Independientemente de ello, se ha estimado que
la transmisión vertical se concreta en 20-50% de las infecciones maternas(15,16).
En la mayoría de los casos la primoinfección por B19V durante el embarazo no
tiene impacto en el resultado de la gestación. Sin embargo, el virus es una
causa importante de morbilidad en el feto (anemia e hidropesía son las
manifestaciones más reconocidas), incluso puede ocasionar muerte fetal,
principalmente cuando la infección intrauterina ocurre en el segundo trimestre
de gestación(17,18).
La prevención y el manejo de las complicaciones potencialmente graves de
la infección perinatal por B19V requiere optimizar el abordaje diagnóstico y
comprender la epidemiología de esta infección viral, particularmente durante el
embarazo. Dado que la infección por B19V durante el embarazo y sus efectos en
el resultado de la gestación son un problema de salud pública escasamente
documentado en nuestro medio, en este trabajo investigamos la seroprevalencia
(IgG) y casos de infección por B19V en pacientes gestantes atendidas en el
Hospital Universitario de Maternidad y Neonatología de Córdoba, Argentina,
durante un año calendario (2021-2022).
Materiales y Métodos
Diseño, población de
estudio, registro de datos, muestras clínicas y método.
Estudio observacional, analítico, de corte
transversal. Fueron incluidas, prospectivamente, pacientes gestantes y/o en
puerperio inmediato (hasta 24 hs. del parto) atendidas en el servicio de
tocoginecología del Hospital Universitario de Maternidad y Neonatología (HUMN)
durante el periodo abril 2021 - mayo 2022. Criterios de exclusión: mujeres
embarazadas atendidas en el HUMN que no finalizaron su embarazo en la
institución, pacientes puérperas derivadas de otras instituciones que ingresan
luego de haber realizado la finalización del embarazo, embarazadas menores de
edad que no cuenten con un responsable adulto para autorizar la inclusión en el
estudio. La selección de los casos estuvo a cargo de los profesionales
especialistas del equipo de investigación, quienes invitaron a participar del
estudio a la embarazada/puérpera (o responsable a cargo en caso de ser menor de
edad). Se dejó constancia escrita de aceptación mediante la firma del
consentimiento informado. A partir de la anamnesis, examen físico y estudios
complementarios de la embarazada/puérpera, se registraron los siguientes datos:
fecha de la extracción de la muestra, edad (años al momento de la concepción),
semana de gestación, antecedente de contacto estrecho y prolongado con menores
de 15 años (convivientes en el hogar, trabajo en jardines maternales y de
infantes, escuelas, personal de salud pediátrica), antecedentes obstétricos
previos (número de paras, hijos vivos), comorbilidades previas y/o enfermedades
crónicas con diagnóstico previo (incluye anemia crónica), patologías asociadas
al embarazo actual (incluye anemia aguda). Además, se interrogó sobre presencia
(en los últimos tres meses o actual) de: anemia, exantema (con o sin fiebre),
síndrome febril, artralgias o artritis inusuales, consignando detalles de su
cronología, posibles diagnósticos realizados, y resolución (siempre
relacionados a este embarazo). Datos del recién nacido (RN): vivo/muerto, edad
gestacional (pretérmino, término o postérmino), peso (adecuado, pequeño,
grande), signos y síntomas (si presenta), diagnósticos establecidos en la
historia clínica, tratamiento y evolución hasta el momento de la admisión. En
todas las embarazadas/puérperas que cumplieron con los criterios de
inclusión/exclusión y aceptaron participar, se obtuvo una muestra de sangre /
alícuota de la obtenida en el marco del procedimiento de rutina y protocolo
habitual de la institución. El manejo clínico de los pacientes estuvo a cargo
del equipo tratante, sin intervención alguna por parte de los investigadores.
Los resultados de la pesquisa de B19V en los casos sospechosos (con
manifestaciones compatibles con la infección por B19) estuvieron a disposición
del médico tratante oportunamente para su seguimiento.
Procesamiento del
material y ensayos de laboratorio.
En todas las muestras de sangre/suero materno
se determinó IgG específica. En las muestras de casos asociables a la infección
por B19V (caso compatible o sospechoso) se realizó PCR para detección de ADN
viral y en las positivas se determinó además IgM anti-B19V. Para las pruebas de
serología se utilizaron ensayos ELISA de las firmas R-Biopharm y Virion Serion,
siguiendo las correspondientes instrucciones del fabricante. Para los ensayos
de biología molecular (extracción de ácidos nucleicos y PCR) se utilizó la
metodología descripta previamente(17,19).
Definición de términos y
variables e interpretación de resultados de laboratorio.
A los fines de este estudio se consideraron
los siguientes términos y definiciones de caso.
·
Embarazada "sana": paciente
en cualquier periodo de gestación y/o en puerperio inmediato (dentro de las 24
horas del parto) sin síntomas parvovirales presentes al momento del ingreso al
estudio (incluye madre/feto/RN).
·
Embarazada no inmune
(susceptible de contraer la infección): resultado negativo en la detección de
IgG específica (IgG-) y sin detección de IgM ni ADN viral en caso de presentar
manifestaciones clínicas compatibles con infección por B19V (IgM-/ADN-).
·
Embarazada inmune: con resultado
positivo en la detección de IgG (IgG+) y sin detección de IgM ni ADN viral en
caso de presentar manifestaciones clínicas compatibles con infección por B19V
(IgM-/ADN-).
·
Caso compatible o sospechoso: paciente
con antecedente y/o presencia actual de manifestaciones clínicas asociables a
la infección por B19V, incluyendo en paciente gestante anemia (según la
definición de la Organización Mundial de la Salud, caracterizada por nivel de
hemoglobina <11.0 g/dL)(20),
exantema, artralgias y/o síndrome febril (durante la gestación), o alteraciones
fetoneonatales (anemia, hidropesía, cardiomegalia, derrame pericárdico, aborto,
muerte fetal intrauterina u otras del espectro
TORCHS/Toxoplasmosis-Otros-Rubéola-Citomegalovirus-Herpes-Sífilis).
·
Caso confirmado: se asumió ante la
presencia de manifestaciones clínicas compatibles con infección por B19V
(antecedente o presencia actual) y resultados de laboratorio virológico
compatible con infección aguda en curso o reciente (IgG-/IgM+/ADN+,
IgG+/IgM+/ADN+, IgG+/IgM-/ADN+).
·
Variables de exposición (factores
asociados a seropositividad materna): edad (años), primera gestación (sí/no),
exposición prolongada a menores de 15 años (si/no).
·
Variables de resultado:
seropositividad B19V (si/no). Infección aguda en curso o reciente (si/no).
Consideraciones éticas.
El estudio fue aprobado por el CIEIS HUMN
(REPIS 4174). Se garantizó la confidencialidad de los datos de los pacientes y
el cumplimiento de las normas éticas vigentes para la investigación en salud
con seres humanos (incluyendo firma de consentimiento informado).
Análisis de datos.
El tamaño muestral se maximizó considerando
una prevalencia de 50%. Teniendo en cuenta una población blanco de 1000
pacientes (promedio de casos atendidos en la institución por año calendario en
el período 2020-2022), nivel de confianza 95%, error 5% y proporción esperada
de pérdidas 10%, la muestra mínima ajustada fue 309. Los resultados se
expresaron mediante medidas de tendencia central y dispersión, frecuencias e
intervalos de confianza del 95% (IC95%). La significancia de las asociaciones
entre factores y seroprevalencia B19V o infección fue evaluada mediante
análisis bivariado (test t, ANOVA, test Chi2, test Exacto de Fisher), con un
nivel α=0,05.
Resultados
Población estudiada
Se estudiaron 317 casos. La edad promedio fue 28,6±5,9 años (rango
16-46), 162 (51,1%, IC95% 46-57) se encontraban cursando el primer embarazo y
153 (48,3%, IC95% 43-54) tenían contacto estrecho con menores de 15 años. En
96/317 (30,3%) se registraron signos/síntomas asociables a la infección por
B19V (casos sospechosos): anemia 76/96 (79,2%, IC95% 70-86), aborto 4 (4,2%,
IC95% 2-10), exantema 7 (7,3%, IC95% 4-14), artralgias 14 (14,6%, IC95% 9-23),
malestar/dolor muscular 1 (1,0%, IC95% 0,2-6), hidropesía fetal 1 (1,0%, IC95%
0,2-6), retardo del crecimiento intrauterino (RCIU) 3 (3,1%, IC95% 1-9).
Seroprevalencia y casos
de infección por B19V
Se detectó IgG anti-B19V en 214/317 (67,5%, IC95% 62-72) pacientes, con
edad promedio 28,4±5,9 años, no significativamente diferente de la muestra
(p=0,72). Las frecuencias de detección por rango etario, paridad, estación
anual, contacto con menores y antecedentes o presencia de manifestaciones
clínicas asociables a B19V se muestran en la Fig. N°1.
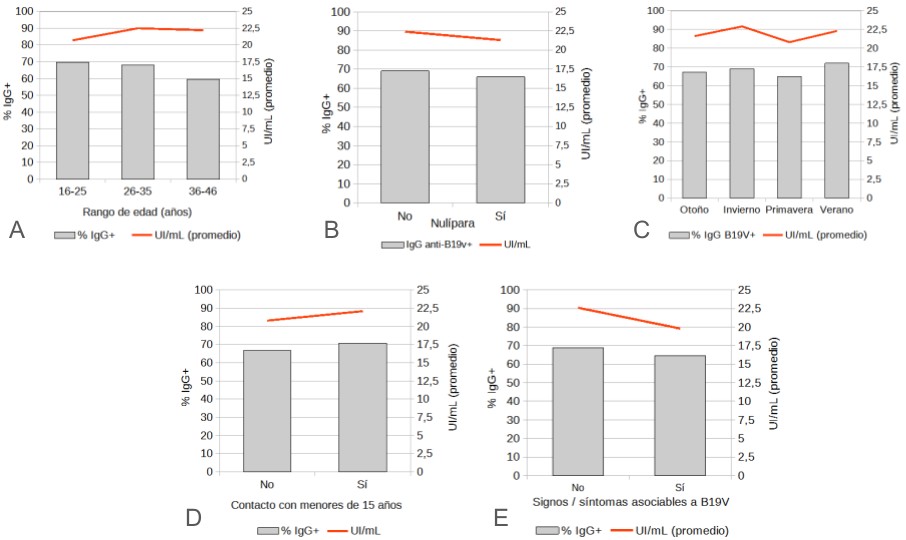
Figura
N° 1. Frecuencias de detección de IgG anti-B19V en
pacientes gestantes del Hospital Universitario de Maternidad y Neonatología
(2021-2022) por grupo etario (A), paridad (B), estación anual (C), contacto
cercano y prolongado con menores (D) y en presencia o no de manifestaciones
clínicas asociables a infección por B19V (E). Las barras indican porcentaje de
positivos (IgG+, eje principal) y las líneas, concentraciones promedio en
unidades internacionales (UI/mL, eje secundario).
No se encontró asociación entre seroprevalencia
y edad (p=0,51), paridad (p=0,54), estacionalidad (p=0,92), exposición a
menores (p=0,43) ni la presencia de signos/síntomas (p=0,50). Tampoco se
identificaron diferencias significativas entre las concentraciones promedio de
anticuerpos por rango etario (p=0,59), paridad (p=0,39), estación (p=0,95) ni
contacto con menores (p=0,33).
Entre los casos sospechosos se identificaron
10/96 (10,4%) casos de infección, todos ellos con anemia, además de un caso con
hidropesía fetal y positivo en la prueba VDRL (coinfección con Treponema
pallidum, Tabla 1).
|
Tabla N °1: Características y marcadores inmunológicos y virológicos
de los casos de infección (confirmados) por B19V en gestantes con
manifestaciones clínicas asociables a la infección. Hospital Universitario de
Maternidad y Neonatología, Córdoba, 2021-2022.
|
|
N.º
|
Año
|
SE
|
Edad
|
Primera
gestación
|
Manifestaciones
clínicas
|
Contacto con
menores
|
PCR B19V
|
IgM B19V
|
UI/mL
|
IgG B19V
|
UI/mL
|
|
|
1
|
2021
|
18
|
26
|
No
|
Anemia
|
Sí
|
Pos
|
Neg
|
-
|
Pos
|
10,5
|
|
|
2
|
2021
|
44
|
33
|
Sí
|
Anemia
|
No
|
Pos
|
Neg
|
-
|
Neg
|
-
|
|
|
3
|
2021
|
50
|
37
|
No
|
Anemia
|
Sí
|
Pos
|
Pos
|
40
|
Pos
|
45,0
|
|
|
4
|
2021
|
42
|
32
|
No
|
Anemia
|
Sí
|
Pos
|
Neg
|
-
|
Neg
|
-
|
|
|
5
|
2022
|
15
|
26
|
No
|
Anemia
|
Sí
|
Pos
|
Pos
|
13
|
Neg
|
-
|
|
|
6
|
2022
|
15
|
23
|
No
|
Anemia.
Hidropesía fetal*
|
Sí
|
Pos
|
Neg
|
-
|
Pos
|
10,5
|
|
|
7
|
2022
|
21
|
29
|
No
|
Anemia
|
Sí
|
Pos
|
Pos
|
15
|
Neg
|
-
|
|
|
8
|
2022
|
21
|
21
|
Sí
|
Anemia
|
No
|
Pos
|
Neg
|
-
|
Pos
|
10,5
|
|
|
9
|
2022
|
22
|
19
|
Sí
|
Anemia
|
No
|
Pos
|
Pos
|
14
|
Neg
|
-
|
|
|
10
|
2022
|
22
|
32
|
No
|
Anemia
|
Sí
|
Pos
|
Neg
|
-
|
Pos
|
10,5
|
|
*Caso positivo en la prueba VDRL. Pos: positivo; Neg:
negativo.
Discusión
En la población y
período estudiados (2021 y 2022) la seroprevalencia (IgG) de B19V fue 67,5%,
exponiendo un 32,5% de embarazadas sin evidencia de inmunidad frente al virus
-susceptible a contraer la infección en el futuro. La seropositividad de
nuestra muestra es coincidente en rango a publicaciones de otros años en
mujeres en edad fértil, así como en embarazadas de la región y del mundo, que
describen tasas del 50 al 70%(1,14,21–25). Estas cifras también
ponen en relevancia la presencia del virus como agente vinculado a la población
gestante, así como la presencia de posibles riesgos de infección futura entre
pacientes de nuestro medio.
En el análisis de
factores asociados a la detección de IgG específica de nuestras embarazadas, no
se identificó asociación entre seroprevalencia y los factores estudiados (edad
materna, paridad, exposición a menores, estacionalidad, presencia de
signos/síntomas asociables a la infección por B19V). Podemos considerar que la
falta de asociación de estas variables con la positividad serológica se
relaciona con los años de reclutamiento, que corresponden a un período
interepidémico. En tal sentido, numerosos reportes dan cuenta de la ocurrencia
de un brote epidémico de B19V durante 2023(2,26,27). Asimismo, en
relación al riesgo de contagio de primoinfección por B19V, se ha reportado que
es mayor entre jóvenes en contacto con niños durante un brote(5,28),
en tanto que en períodos interepidémicos no se ha observado riesgo ocupacional
ni asociado con la edad materna de infección por B19V(8).
La frecuencia de
detección de infección por B19V en los casos compatibles (por sospecha clínica)
fue del 10,4%. En todos ellos se identificó anemia materna, siendo este el
único síntoma clínico presente con la excepción de un caso en el que además se
registró hidropesía fetal (infección congénita grave). Esta prevalencia de
infección por B19V en embarazadas con signos/síntomas compatibles es
equivalente a la de grupos similares reportada en otros estudios(13).
Por otra parte, el diagnóstico temprano de infección materna sólo en función de
los marcadores clínicos clásicos (exantema, fiebre, artralgia, adenopatía,
astenia) enfrenta el inconveniente de la elevada proporción de mujeres
embarazadas que no presentan síntomas que conduzcan a la sospecha(14).
Entre todos los criterios de definición de caso tenidos en cuenta en este
estudio, el signo predominante en nuestra serie fue anemia materna. Los
resultados sugieren la importancia de alta sospecha de infección por B19V
durante el embarazo con una definición de caso amplia que incluya tanto
síntomas maternos como del producto de la gestación.
Los marcadores
laboratoriales de infección (serología/PCR) en los casos sospechosos muestran
que 40% fueron identificados por la detección viral (ADN+/IgG+), 40% mediante
la detección viral concomitante con el marcador serológico de primoinfección
(ADN+/IgM+), en tanto que 20% no evidenciaron marcadores de respuesta
inmunológica específica (Tabla N° 1). La detección molecular acompañada por
distintas combinaciones de marcadores serológicos (incluso su ausencia) ha sido
ampliamente documentada en estudios previos; puede deberse a la detección
tardía en relación al posible momento de contagio o a infecciones maternas muy
recientes(29,30). Este dato
es relevante como evidencia de la importancia de incluir a la PCR como
complemento a la serología al realizar pruebas de infección por B19V. Si bien
podría considerarse un resultado falso positivo debido a contaminación cruzada
de la PCR en algún caso (N°2, Tabla N° 1), no se puede definir este resultado
completamente, de hecho, todas las pruebas de laboratorio se realizaron
siguiendo los estándares metodológicos y de seguridad para minimizar este
riesgo.
Fortalezas del estudio:
La inclusión de una
muestra representativa de la población estudiada (pacientes gestantes del HUMN)
y el abordaje laboratorial que incluye tanto marcadores serológicos como
virológicos para la interpretación de los casos de infección en embarazadas con
síntomas maternos y/o del producto de la gestación.
Entre las
limitaciones del estudio podemos mencionar que solo se testearon marcadores de
infección aguda (ADN viral e IgM) en los casos compatibles o sospechosos (según
definición de caso). Debido a esto no es posible estimar tasa de infección
materna para la población estudiada (casos asintomáticos) por lo que la
frecuencia de infección materna por B19V puede estar subestimada. Además, por
tratarse de una investigación de corte transversal, no fue posible determinar
seroconversión en una segunda muestra (cambio de IgG negativa a positiva), lo
que podría haber complementado la detección de casos de primoinfección materna,
en particular cuando el diagnóstico tardío no permite ya detectar ADN o IgM.
Cabe destacar que a
pesar de que B19V es reconocido como un agente fetotrópico que puede conducir a
la pérdida fetal, su pesquisa no está incluida entre los controles de rutina
prenatal. Su presencia debería estar siempre investigada ante situaciones
clínicas compatibles con anemia materna y alteraciones fetales. Para el
abordaje diagnóstico de la infección materna y/o vertical por B19V se
recomienda un enfoque multiparamétrico(10), combinando la detección
de anticuerpos específicos con la del ADN viral en sangre periférica (Tabla 1)
en casos sospechosos por clínica y exposición/contacto con casos confirmados.
Bibliografía
1. Pedranti
MS, Barbero P, Wolff C, Ghietto LM, Zapata M, Adamo MP. Infection and
immunity for human parvovirus B19 in patients with febrile exanthema. Epidemiol
Infect. 2012 Mar;140(3):454-61. doi: 10.1017/S0950268811000823.
2. Patalon
T, Saciuk Y, Trotzky D, Pachys G, Ben-Tov A, Segal Y, Gazit S. An Outbreak of
Parvovirus B19 in Israel. Viruses. 2023 Nov 16;15(11):2261. doi:
10.3390/v15112261.
3. van
Gessel PH, Gaytant MA, Vossen AC, Galama JM, Ursem NT, Steegers EA, Wildschut
HI. Incidence of parvovirus B19 infection among an unselected population of
pregnant women in the Netherlands: A prospective study. Eur J Obstet Gynecol
Reprod Biol. 2006 Sep-Oct;128(1-2):46-9. doi: 10.1016/j.ejogrb.2005.11.042.
4. Mossong
J, Hens N, Friederichs V, Davidkin I, Broman M, Litwinska B, Siennicka J,
Trzcinska A, VAN Damme P, Beutels P, Vyse A, Shkedy Z, Aerts M, Massari M,
Gabutti G. Parvovirus B19 infection in five European countries:
seroepidemiology, force of infection and maternal risk of infection. Epidemiol
Infect. 2008 Aug;136(8):1059-68. doi: 10.1017/S0950268807009661.
5. Jensen
IP, Thorsen P, Jeune B, Møller BR, Vestergaard BF. An epidemic of parvovirus
B19 in a population of 3596 pregnant women: A study of sociodemographic and
medical risk factors. BJOG Int J Obstet Gynaecol. 2000;107(5):637-643.
doi:10.1111/j.1471-0528.2000.tb13306.x
6. Plummer
FA, Hammond GW, Forward K, Sekla L, Thompson LM, Jones SE, Kidd IM, Anderson
MJ. An erythema infectiosum-like illness caused by human parvovirus infection.
N Engl J Med. 1985 Jul 11;313(2):74-9. doi: 10.1056/NEJM198507113130203.
7. Chorba T,
Coccia P, Holman RC, Tattersall P, Anderson LJ, Sudman J, Young NS, Kurczynski
E, Saarinen UM, Moir R, et al. The role of parvovirus B19 in aplastic crisis
and erythema infectiosum (fifth disease). J Infect Dis. 1986 Sep;154(3):383-93.
doi: 10.1093/infdis/154.3.383.
8. Stelma
FF, Smismans A, Goossens VJ, Bruggeman CA, Hoebe CJ. Occupational risk of human
Cytomegalovirus and Parvovirus B19 infection in female day care personnel in
the Netherlands; a study based on seroprevalence. Eur J Clin Microbiol Infect
Dis. 2009 Apr;28(4):393-7. doi: 10.1007/s10096-008-0635-y.
9. Centers
for Disease Control and Prevention (U.S.) MMWR. Morbidity and Mortality Weekly
Report. 1989 Feb 17; 38 (6): 81-100. Disponible en:
https://stacks.cdc.gov/view/cdc/35806
10. Gallinella
G. The clinical use of parvovirus B19 assays: recent advances. Expert Rev Mol
Diagn. 2018 Sep;18(9):821-832. doi: 10.1080/14737159.2018.1503537.
11. Harger
JH, Adler SP, Koch WC, Harger GF. Prospective evaluation of 618 pregnant women
exposed to parvovirus B19: risks and symptoms. Obstet Gynecol. 1998
Mar;91(3):413-20. doi: 10.1016/s0029-7844(97)00701-1.
12. Noyola
DE, Padilla-Ruiz ML, Obregón-Ramos MG, Zayas P, Pérez-Romano B. Parvovirus B19
infection in medical students during a hospital outbreak. J Med Microbiol. 2004
Feb;53(Pt 2):141-146. doi: 10.1099/jmm.0.05417-0
13. Chisaka
H, Ito K, Niikura H, Sugawara J, Takano T, Murakami T, Terada Y, Okamura K,
Shiroishi H, Sugamura K, Yaegashi N. Clinical manifestations and outcomes of
parvovirus B19 infection during pregnancy in Japan. Tohoku J Exp Med. 2006
Aug;209(4):277-83. doi: 10.1620/tjem.209.277.
14. Watt AP,
Brown M, Pathiraja M, Anbazhagan A, Coyle PV. The lack of routine surveillance
of Parvovirus B19 infection in pregnancy prevents an accurate understanding of
this regular cause of fetal loss and the risks posed by occupational exposure.
J Med Microbiol. 2013 Jan;62(Pt 1):86-92. doi: 10.1099/jmm.0.046714-0.
15. Prospective
study of human parvovirus (B19) infection in pregnancy. Public Health
Laboratory Service Working Party on Fifth Disease. BMJ. 1990 May
5;300(6733):1166-70. doi: 10.1136/bmj.300.6733.1166.
16. Yaegashi
N. Pathogenesis of nonimmune hydrops fetalis caused by intrauterine B19
infection. Tohoku J Exp Med. 2000 Feb;190(2):65-82. doi: 10.1620/tjem.190.65.
17. Bertoldi
A, Colazo Salbetti MB, Rodríguez G, Tenaglia M, Hernández G, Alfaro J, Riberi
MI, Olivera NL, Pedranti M, Isa MB, Adamo MP. Human parvovirus B19 infection in
a pregnant patient resulting in severe hydrops, foetal death and persistent
infection. Access Microbiol. 2022 Oct 3;4(10):acmi000428. doi:
10.1099/acmi.0.000428.
18. Dittmer
FP, Guimarães CM, Peixoto AB, Pontes KFM, Bonasoni MP, Tonni G, Araujo Júnior
E. Parvovirus B19 Infection and Pregnancy: Review of the Current Knowledge. J
Pers Med. 2024 Jan 26;14(2):139. doi: 10.3390/jpm14020139.
19. Salbetti
MB, Pedranti MS, Barbero P, Molisani P, Lazzari M, Olivera N, Isa MB, Bertoldi
A, Moreno L, Adamo MP. Molecular screening of the human parvoviruses B19 and
bocavirus 1 in the study of congenital diseases as applied to symptomatic
pregnant women and children. Access Microbiol. 2019 Jun 20;1(5):e000037. doi:
10.1099/acmi.0.000037.
20. Okia CC,
Aine B, Kiiza R, Omuba P, Wagubi R, Muwanguzi E, Apecu RO, Okongo B, Oyet C.
Prevalence, Morphological Classification, And Factors Associated With Anemia
Among Pregnant Women Accessing Antenatal Clinic At Itojo Hospital, South
Western Uganda. J Blood Med. 2019 Oct 22;10:351-357. doi: 10.2147/JBM.S216613.
21. Valeur-Jensen
AK, Pedersen CB, Westergaard T, Jensen IP, Lebech M, Andersen PK, Aaby P,
Pedersen BN, Melbye M. Risk factors for parvovirus B19 infection in pregnancy. JAMA. 1999 Mar
24-31;281(12):1099-105. doi: 10.1001/jama.281.12.1099.
22. Pedranti
MS, Adamo MP, Macedo R, Zapata MT. Prevalencia de anticuerpos antirrubéola y
antiparvovirus B19 en embarazadas de la ciudad de Córdoba y en mujeres en edad
fértil de la ciudad de Villa Mercedes, San Luis. Rev Argent Microbiol.
2007;39(1):47-50. Disponible en:
https://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-75412007000100012
23. Adamo MP,
Blanco S, Viale F, Rivadera S, Rodríguez-Lombardi G, Pedranti M, Carrizo H,
Gallego S. Human parvovirus B19 frequency among blood donors after an epidemic
outbreak: relevance of the epidemiological scenario for transfusion medicine.
Heliyon. 2020 May 4;6(5):e03869. doi: 10.1016/j.heliyon.2020.e03869.
24. De
Paschale M, Pavia C, Cerulli T, Cagnin D, Manco MT, Belvisi L, Paganini A,
Pogliani L, Ceriani E, Porta A, Parola L, Mirri P, Osnaghi B, Vismara L,
Clerici P. Prevalence of anti-parvovirus B19 IgG and IgM and parvovirus B19
viremia in pregnant women in an urban area of Northern Italy. J Med Virol. 2022
Nov;94(11):5409-5414. doi: 10.1002/jmv.27963.
25. Taherkhani
R, Farshadpour F, Norozi M. Molecular Evaluation of Human Parvovirus B19
Infection and Associated Risk Factors among Pregnant Women in Bushehr Province,
Southern Iran. Am J Trop Med Hyg. 2022 Mar 7;106(5):1539–46. doi:
10.4269/ajtmh.21-1088.
26. Fourgeaud
J, Allali S, Toubiana J, Pinhas Y, Frange P, Leruez-Ville M, Cohen JF.
Post-COVID-19 pandemic outbreak of severe Parvovirus B19 primary infections in
Paris, France: 10-year interrupted time-series analysis (2012-2023). J Clin
Virol. 2023 Oct;167:105576. doi: 10.1016/j.jcv.2023.105576.
27. Vuković
V, Patić A, Ristić M, Kovačević G, Hrnjaković Cvjetković I, Petrović V.
Seroepidemiology of Human Parvovirus B19 Infection among the Population of
Vojvodina, Serbia, over a 16-Year Period (2008-2023). Viruses. 2024 Jan
25;16(2):180. doi: 10.3390/v16020180.
28. Radauceanu
A, Bouslama M. Risks for adverse pregnancy outcomes and infections in daycare
workers: an overview of current epidemiological evidence and implications for
primary prevention. Int J Occup Med Environ Health. 2020 Oct 20;33(6):733-756.
doi: 10.13075/ijomeh.1896.01549.
29. Zavattoni
M, Paolucci S, Sarasini A, Tassis B, Rustico M, Quarenghi A, Piralla A,
Baldanti F. Diagnostic and prognostic value of molecular and serological
investigation of human parvovirus B19 infection during pregnancy. New Microbiol.
2016 Jul;39(3):181-185.
30. Barlinn
R, Rollag H, Trogstad L, Vainio K, Basset C, Magnus P, Dudman SG. High
incidence of maternal parvovirus B19 infection in a large unselected
population-based pregnancy cohort in Norway. J Clin Virol. 2017 Sep;94:57-62.
doi: 10.1016/j.jcv.2017.07.010.
Limitaciones
de responsabilidad:
La responsabilidad del trabajo es exclusivamente de
quienes colaboraron en la elaboración del mismo.
Conflicto
de interés:
Ninguno.
Fuentes
de apoyo:
SECYT – UNC (33620180100437CB) y ANPCYT – FONCYT
PICT-2019-4600..
Originalidad:
Este artículo es original y no ha sido enviado para
su publicación a otro medio de difusión científica en forma completa ni
parcialmente.
Cesión
de derechos:
Los/as autores/as cedemos el derecho de autor a la
Universidad Nacional de Córdoba para publicar en la Revista de la Facultad de
Ciencias Médicas de Córdoba, realizar la traducción al idioma inglés y enviar
los metadatos a diferentes bases de datos para su indización.
Contribución
de los autores:
Quienes participaron en la elaboración de este
artículo, han trabajado en la concepción del diseño, recolección de la
información y elaboración del manuscrito, haciéndose públicamente responsables
de su contenido y aprobando su versión final.
Recibido: 2024-04-15 Aceptado: 2024-09-25
 DOI:
http://dx.doi.org/10.31053/1853.0605.v81.n4.44771
DOI:
http://dx.doi.org/10.31053/1853.0605.v81.n4.44771
 https://creativecommons.org/licenses/by-nc/4.0/
https://creativecommons.org/licenses/by-nc/4.0/
©Universidad
Nacional de Córdoba