VEGETALES DE HOJAS COMO POTENCIALES TRANSMISORES DE NOROVIRUS EN LA
CIUDAD DE CÓRDOBA, ARGENTINA
LEAFY VEGETABLES AS POTENTIAL TRANSMITTERS OF NOROVIRUS IN CORDOBA
CITY, ARGENTINA
VEGETAIS DE FOLHA COMO POTENCIAIS TRANSMISSORES DE NOROVIRUS DA
CIDADE DE CÓRDOBA, ARGENTINA
María Laura Coluccini1.
1-
Mgter en Microbiología con Orientación en Investigación en Salud
Humana. Universidad Nacional de Córdoba. Facultad de Ciencias
Médicas. Escuela de Nutrición. Cátedra de Microbiología y
Parasitología; Argentina. E-mail de contacto:
laucolu@hotmail.com
Conceptos clave:
Los NoV constituyen un importante patógeno causante de gastroenteritis
por transmisión alimentaria en el mundo y en todos los grupos etarios.
En Argentina los estudios de brotes son escasos y no existía hasta el
presente ningún estudio de contaminación viral en vegetales consumidos
por humanos.
El presente trabajo, constituye el primer reporte en nuestro país de
detección de NoV en vegetales de hoja, alertando la necesidad de tomar
medidas de control, ya que la población que los consume estaría
expuesta a un riesgo potencial.
Resumen:
Introducción: Los Norovirus (NoV) constituyen un género dentro de
la familia viral Caliciviridae, siendo el principal causante de
brotes de origen alimentario entre humanos. Los vegetales frescos
son susceptibles de ser contaminados con estos patógenos durante su
cultivo, cosecha, transporte, procesamiento y manipulación. Por lo
que se pretendió determinar la frecuencia de detección de NoV en
muestras vegetales de hojas de la Ciudad de Córdoba, y adaptar un
método de concentración viral con polietilenglicol para la
recuperación de partículas virales de la superficie de vegetales y
caracterizar los genogrupos de NoV detectados.
Métodos: Se tomaron 19 muestras de vegetales de hoja entre junio y
diciembre de 2012. Se aplicó una técnica de concentración viral
validada previamente en el laboratorio (elución y precipitación con
polietilenglicol). A los concentrados de las muestras se les extrajo el
ARN viral utilizando Trizol y precipitación con alcohol isopropílico.
Se amplificó el ácido nucleico por Rt-PCR con primers específicos para
identificar genogrupos I (GI) y II (GII). Los productos de la
amplificacion fueron revelados por electroforesis en geles de
poliacrilamida y tinción argéntica.
Resultados: Se encontraron 57,89% muestras positivas. Diez de las de
cepas detectadas pertenecieron al genogrupo I (GI) y una al genogrupo
II (GII). Se identificaron a lo largo de todo el periodo estudio,
particularmente durante los meses de agosto, septiembre y noviembre.
Conclusión: Se detectó a estos patógenos con una prevalencia de 57,89
%. Las cepas pertenecieron mayoritariamente al GI, representando un
riesgo potencial para la población.
Palabras clave:
norovirus; vegetales; alimentos; brote
.
Abstract:
Introduction: The Norovirus (NoV) constitute a genus within the viral
family Caliciviridae, being the main cause of outbreaks of food origin
among humans. Fresh vegetables are susceptible to being contaminated
with these pathogens during their cultivation, harvest, transport,
processing and handling. So it was intended to determine the frequency
of detection of NoV in plant samples of leaves of the City of Córdoba,
and adapt a method of viral concentration with polyethylene glycol for
the recovery of viral particles from the surface of vegetables and
characterize the genogroups of NoV detected.
Methods: 19 samples of leafy vegetables were taken between June and
December 2012. A viral concentration technique previously validated in
the laboratory was applied (elution and precipitation with polyethylene
glycol). The viral RNA was extracted to the concentrates of the samples
using Trizol and precipitation with isopropyl alcohol. The nucleic acid
was amplified by Rt-PCR with specific primers to identify genogroups I
(GI) and II (GII). The products of the amplification were revealed by
polyacrylamide gel electrophoresis and silver staining.
Results: We found 57.89% positive samples. Ten of the detected strains
belonged to genogroup I (GI) and one to genogroup II (GII). They were
identified throughout the study period, particularly during the months
of August, September and November.
Conclusion: These pathogens were detected with a prevalence of 57.89%.
The strains belonged mainly to the GI, representing a potential risk
for the population.
Keywords:
norovirus; vegetables; food; sprout.
Resumo
Introdução: Os Norovírus (NoV) constituem um gênero dentro da família
viral Caliciviridae, sendo a principal causa de surtos de origem
alimentar nos humanos. Os vegetais frescos são susceptíveis a serem
contaminados com estes patógenos durante seu cultivo, colheita,
transporte, processamento e manipulação. O objetivo foi determinar a
frequência de detecção de NoV em amostras de vegetais de folha da
cidade de Córdoba, adaptando um método de concentração viral com
polietilenoglicol para a recuperação de partículas virais da superfície
de vegetais e caracterizar os genogrupos de NoV detectados.
Métodos: Colheram-se dezenove amostras de vegetais de folha entre junho
e dezembro de 2012. Aplicou-se uma técnica de concentração viral
validada com antecedência no laboratório (eluição e precipitação com
polietilenoglicol). Extraiu-se o RNA viral com Trizol e precipitação
com álcool isopropílico dos concentrados das amostras. Amplificou-se o
ácido nucleico por RT-PCR com primers específicos para identificar
genogrupos I (GI) e II (GII). Os produtos da amplificação revelaram-se
por electroforese em géis de poliacrilamida e tinção argírica.
Resultados: Encontraram-se 57.89% de amostras positivas. Dez cepas
pertenceram ao genogrupo I (GI) e uma ao genogrupo GII (GII).
Identificaram-se ao longo de todo o período de estudo; especialmente
durante os meses de agosto, setembro e novembro.
Conclusão: A prevalência deste patógeno foi de 57.89%. A maioria das
cepas pertenceu ao GI, representando um risco potencial para a
população.
Palavras chave: Norovírus; vegetais; alimentos, surto.
Palavras-chave: Norovírus; vegetais; alimentos,
surto
Introducción
Los Norovirus (NoV) son agentes causales de brotes epidémicos por
gastroenteritis en individuos de todas las edades, siendo responsables
de más del 90% de las mismas por causa no bacteriana en todo el mundo (1).
Éstos agentes constituyen un género dentro de la familia viral
Caliciviridae. Son virus de genoma ARN de sentido positivo, de cadena
simple y no envueltos, de 27 a 32 nm de tamaño y poseen una cápside
icosaedrica(2).
Los NoV pueden causar la contaminación de frutas y verduras y
transmitirse a un gran número de consumidores, causando de este modo un
brote por transmisión alimentaria.
En el año 2008, el Centers of Diseases Control and Prevention (CDC)
reportó a los NoV como los agentes más frecuentes y confirmado por
laboratorio como único patógeno causal en el 49 % de 479 brotes
registrados en ese año. Los brotes ocurren particularmente en
establecimientos de salud, educación, geriátricos, militares y en otras
instituciones donde la transmisión se ve facilitada por la presencia de
un gran número de individuos en estrecho contacto(3).
Los vegetales frescos son susceptibles de ser contaminados con estos
patógenos durante su cultivo al tomar contacto con el agua de riego
contaminada o fertilizante orgánico, posterior cosecha, transporte,
procesamiento y manipulación. Como la mayoría de estos vegetales se
consumen crudos, se observó en estudios en países en desarrollo un
incremento en el número de brotes alimentarios asociados al consumo de
los mismos(4-5).
El consumo de vegetales frescos es promovido como parte de una dieta
saludable para la población, sin embargo ésto podría suponer un riesgo
potencial para la salud pública, ya que una amplia variedad de
vegetales de hoja se consumen crudos.
Si bien en países altamente desarrollados se cuenta con datos
importantes acerca de las transmisiones de enfermedades víricas a
través de alimentos(6-8), en nuestro país no se cuanta con
información al respecto. Está claro que hasta el momento no se está en
condiciones de valorar el posible impacto en salud de la transmisión
alimentaria de virus en nuestra región y es imperiosamente necesario el
comienzo de estudios en este ámbito. El presente constituye el primer
reporte en nuestro país sobre la presencia de estos agentes virales en
alimentos.
-Determinar la frecuencia de detección de NoV en muestras de alimentos
(vegetales de hojas) comercializados en un puesto mayorista del mercado
de abasto de la Ciudad de Córdoba.
-Implementar un método de concentración viral con polietilenglicol para
la recuperación de partículas virales. Caracterizar los genogrupos de
NoV involucrados en la contaminación de las verduras estudiadas.
Métodos
Se recolectaron 19 muestras de vegetales de hoja (lechuga, lechuga
colorada, acelga, achicoria, rúcula y espinaca), de aproximadamente 800
a 1000 gr cada una, de un mismo proveedor del Mercado de Abasto de la
ciudad de Córdoba seleccionado al azar. El muestreo se realizó entre
junio y diciembre de 2012 con frecuencia quincenal. Se aplicó una
técnica de concentración viral validada previamente en el laboratorio,
con ligeras modificaciones(9).
Brevemente, las partículas contenidas en 1,5 litros de buffer de lavado
de muestra fueron concentradas cien veces en un volumen final de 15 ml
mediante centrifugación-elusión con polietilenglicol.
La extracción del ácido nucleico se realizó con Trizol-cloroformo y
posterior precipitación en alcohol isopropílico, partiendo de 400 µL de
concentrado de la muestra(5).
El ARN extraído se desnaturalizó a 97°C durante 7 minutos y se sometió
a retrotranscripción con random primers. La detección
específica de NoV se realizó por semi-nested PCR utilizando primers dirigidos a la región A del gen de la polimerasa
viral. La primera reacción detecta los genogrupos I y II de NoV
obteniéndose un producto de 327 pb, mientras que las dos segundas
reacciones por separado diferencian los genogrupos I (187 pb) y II (236
pb)(10).
Los amplicones fueron revelados mediante electroforesis en geles de
poliacrilamida y tinción con plata(11).
Los datos se analizaron mediante determinación de frecuencias de
detección según las variables estacionales y especie del vegetal.
Comités de ética
La investigación se ha realizado con muestras ambientales, no incluye
muestras humanas, por lo tanto no fue necesaria la obtención de
consentimientos y revisión por un Comité de Ética, según los principios
de la Declaración de Helsinki.
Resultados
Del total de 19 muestras analizadas, 11 de ellas resultaron positivas
para NoV (57,89 %). Se observó que, de las seis especies de vegetales
de hoja estudiados, se detectaron muestras positivas en cinco de ellas
(lechuga, acelga, achicoria, espinaca y rúcula). Sorprendentemente,
cuatro de ellas se consumen crudas. Diez de las cepas detectadas
pertenecieron al GI y una al GII. (Tabla 1).
Se observó presencia de NoV intermitentemente durante todo el periodo
estudiado, principalmente en los meses de agosto, septiembre y
noviembre. (Figura 1).
|
Tabla N° 1: Resultados por distintos protocolos
de RT-PCR de las muestras analizadas
|
|
Nº de Muestras
|
Tipo de vegetal
|
Mes que se adquirió y cosechó
|
Resultados por Rt-PCR
(Vennema et al 2002)
RdRP
|
|
1
|
Lechuga
|
12/6/2012
|
-
|
|
2
|
Lechuga
|
27/6/2012
|
-
|
|
3
|
Espinaca
|
8/8/2012
|
-
|
|
4
|
Lechuga
|
15/8/2012
|
-
|
|
5
|
Achicoria
|
15/8/2012
|
GI
|
|
6
|
Rúcula
|
22/8/2012
|
GI
|
|
7
|
Espinaca
|
22/8/2012
|
GI
|
|
8
|
Acelga
|
5/9/2012
|
GI
|
|
9
|
Lechuga
|
5/9/2012
|
GI
|
|
10
|
Rúcula
|
12/9/2012
|
GI
|
|
11
|
Espinaca
|
12/9/2012
|
-
|
|
12
|
Acelga
|
3/10/2012
|
GI
|
|
13
|
Lechuga
|
3/10/2012
|
-
|
|
14
|
Acelga
|
24/10/2012
|
-
|
|
15
|
Lechuga colorada
|
24/10/2012
|
-
|
|
16
|
Lechuga
|
15/11/2012
|
GI/ GII
|
|
17
|
Acelga
|
15/11/2012
|
GI
|
|
18
|
Achicoria
|
28/11/2012
|
GI
|
|
19
|
Acelga
|
28/11/2012
|
GI
|
|
Resultados de RT-PCR de las muestras
analizadas.
|
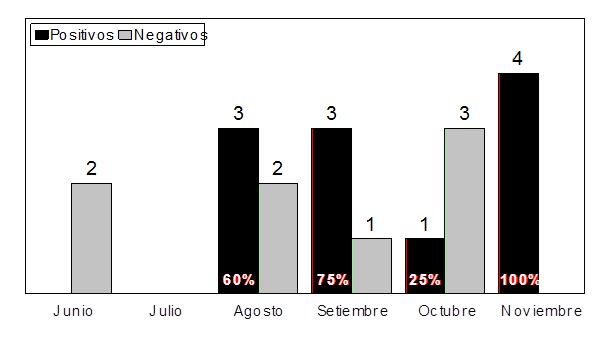
Figura N° 1. Distribución de muestras positivas y negativas
según mes del año en el periodo estudiado (junio-noviembre
2012)
Discusión
En la actualidad, y en países con un alto grado de desarrollo, las
infecciones alimentarias de origen viral constituyen una preocupación mayor
tanto para el sector de alimentos como para el ámbito de la salud. Los
patógenos virales implicados son esencialmente los virus entéricos que
constituyen un conjunto de virus transmisibles al humano vía los alimentos
contaminados, agua y contactos interpersonales(12).
En el plano epidemiológico, los norovirus son corrientemente reportados
entre los casos de gastroenteritis no bacteriana. En el mundo entero, tanto
en países en vías de desarrollo como desarrollados, causan enfermedad
moderada a severa afectando todas las edades, con una gran carga entre los
niños: 9 millones de hospitalizaciones y 2 millones de muertes por año
entre los menores de cinco años en países en vías de desarrollo y alrededor
de 500 mil hospitalizaciones por año en países desarrollados para el mismo
grupo etario(13-14).
En Estados Unidos, serían responsables del 58% de los casos anuales de
enfermedades transmitidas por alimentos con pérdidas económicas estimadas
en 3,7 mil millones de dólares por año(15), Desde hace más de
una década, han sido reportados brotes epidémicos de diversa severidad en
Canadá(16), y en numerosos países europeos(17). Los
datos más recientes dan cuenta de un aumento de las incidencias en Gran
Bretaña(18), Países Bajos(19), Japón(20),
en Francia, Australia y Nueva Zelanda(21). En los países de
América del Sur, no existen programas de eliminación y control de las
gastroenteritis producidas por norovirus, por lo tanto los datos son
escasos y dispersos. Los rangos de prevalencia reportados en estos países
son: Brasil: 14,5%, Venezuela: 16,76%, Chile: 17,4%, Argentina: 24% y
Colombia: 32%(22).
Los datos en Argentina, si bien son escasos, adquieren relevancia, ya que
dan cuenta de la existencia de brotes de gastroenteritis por causa de
norovirus en nuestro país(23-25), y la posible subestimación que
exista de la prevalencia de esta patología. Asimismo, no se cuenta al
presente en Argentina con reportes acerca de monitoreo viral en diferentes
matrices alimentarias, lo cual resulta fundamental a fin de perfeccionar
técnicas sensibles y específicas para establecer potenciales fuentes de
contaminación y estimar el riesgo al que la población que consume dichos
alimentos está expuesta.
Se planteó realizar un estudio de detección de NoV en verduras de hoja
comercializadas en el mercado de abasto de nuestra ciudad.
Sorprendentemente, los resultados arrojaron una prevalencia de 57,89%
(11/19), la más alta frente a otros reportes recientes que dan cuenta de
una prevalencia del 11,9% en Francia(26), 10% en España (8), 28,2% en Canadá y 33,3% en Bélgica(7). Si bien
estos estudios difieren en la metodología empleada para el muestreo y
detección entre sí, constituyen los escasos reportes con los que se cuenta
para establecer una comparación preliminar. Cuatro de las seis variedades
de vegetales estudiados, se consumen crudos como lechuga, achicoria,
espinaca y rúcula, mientras que la restante fue acelga, que generalmente se
consume cocida, si bien como todo alimento es manipulado en la cocina y
puede entrar en contacto con utensilios y demás superficies contaminadas.
En cuanto a la estacionalidad de las muestras analizadas (Figura 1), se han
encontrado especímenes positivos durante los meses fríos como cálidos
(junio, agosto, septiembre y noviembre), y no se ha podido advertir un
único patrón estacional con picos elevados en invierno como sucede en los
muestreos clínicos, sino que similarmente a otros reportes en muestras
ambientales, los hallazgos positivos parecerían suceder a lo largo del año
y con algún pico primaveral. En el presente trabajo, la mayoría (10/19) de
muestras positivas resultaron pertenecer al GI, mientras que tan sólo una,
resultó positiva para GII. Este hallazgo a priori llama la
atención debido a que se conoce que la mayoría de las cepas que circulan en
humanos pertenecen al GII y que GI se encuentra en menor proporción en
muestras clínicas. Dependiendo del año, cerca del 75 al 95 % de los brotes
de NoV del mundo son debidos a virus GII y del 5 al 25 % se deben a virus
GI, mientras que muy rara vez se han identificado virus GIV. Sin embargo,
se ha evidenciado que cepas pertenecientes al genotipo GII.4 estarían
implicadas en los casos de contaminación de persona a persona, mientras que
cepas del genogrupo GI estarían más bien ligadas a productos de mar y
vegetales frescos(8).
Conclusiones
En este primer estudio realizado en Argentina, se detectó NoV en vegetales
de hojas que se comercializan en la ciudad de Córdoba con una frecuencia de
detección del 57,91%.
Las cepas detectadas pertenecen mayoritariamente al GI, coincidiendo con
otros reportes de NoV en alimentos, mientras que tan solo una cepa resultó
pertenecer al genogrupo II (GII).
La alta frecuencia de detección de NoV en vegetales de hojas pone de
manifiesto el riesgo potencial al que la población que los consume esté
expuesta.
Se sugiere continuar con estos estudios, particularmente aplicando técnicas
de cuantificación a fin de realizar cálculos de riesgo de infección; como
así también secuenciar las cepas detectadas y compararlas con aquellas
cepas de muestras clínicas de individuos afectados.
Conflictos de interés
No existen.
Limitaciones de responsabilidad
La responsabilidad del trabajo es sólo del autor
Bibliografía
1. Verhoef L, Depoortere E, Boxman I, Duizer E, van Duynhoven Y, Harris
J, Johnsen C, Kroneman A, Le Guyader S, Lim W, Maunula L, Meldal H,
Ratcliff R, Reuter G, Schreier E, Siebenga J, Vainio K, Varela C,
Vennema H, Koopmans M; Food Borne Viruses in Europe Network. Emergence
of new norovirus variants on spring cruise ships and prediction of
winter epidemics. Emerg Infect Dis. 2008 Feb;14(2):238-43. doi:
10.3201/eid1402.061567.
2. Lin CY, Chiu NC, Lee HC, Chuang CK, Lin SP, Yeung CY. The emerging
importance of norovirus as the etiology of pediatric gastroenteritis in
Taipei. J Microbiol Immunol Infect. 2010 Apr;43(2):105-10. doi:
10.1016/S1684-1182(10)60017-5.
3. Centers for Disease Control and Prevention (CDC). Surveillance for
foodborne disease outbreaks--United States, 2008. MMWR Morb Mortal Wkly
Rep. 2011 Sep 9;60(35):1197-202.
4. Mueller JE, Bessaud M, Huang QS, Martinez LC, Barril PA, Morel V,
Balanant J, Bocacao J, Hewitt J, Gessner BD, Delpeyroux F, Nates SV.
Environmental poliovirus surveillance during oral poliovirus vaccine
and inactivated poliovirus vaccine use in Córdoba Province, Argentina.
Appl Environ Microbiol. 2009 Mar;75(5):1395-401. doi:
10.1128/AEM.02201-08.
5. Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid
guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem.
1987 Apr;162(1):156-9. doi: 10.1006/abio.1987.9999.
6. Pérez-Rodríguez F, González-García P, Valero A, Hernández M,
Rodríguez-Lázaro D. Impact of the prevalence of different pathogens on
the performance of sampling plans in lettuce products. Int J Food
Microbiol. 2014 Aug 1;184:69-73. doi:
10.1016/j.ijfoodmicro.2014.04.019.
7. Baert L, Mattison K, Loisy-Hamon F, Harlow J, Martyres A, Lebeau B,
Stals A, Van Coillie E, Herman L, Uyttendaele M. Review: norovirus
prevalence in Belgian, Canadian and French fresh produce: a threat to
human health? Int J Food Microbiol. 2011 Dec 15;151(3):261-9. doi:
10.1016/j.ijfoodmicro.2011.09.013.
8. Le Guyader F, Loisy F, Atmar RL, Hutson AM, Estes MK, Ruvoën-Clouet
N, Pommepuy M, Le Pendu J. Norwalk virus-specific binding to oyster
digestive tissues. Emerg Infect Dis. 2006 Jun;12(6):931-6. doi:
10.3201/eid1206.051519.
9. Guévremont E, Brassard J, Houde A, Simard C, Trottier YL.
Development of an extraction and concentration procedure and comparison
of RT-PCR primer systems for the detection of hepatitis A virus and
norovirus GII in green onions. J Virol Methods. 2006
Jun;134(1-2):130-5. doi: 10.1016/j.jviromet.2005.12.009.
10. Vennema H, de Bruin E, Koopmans M. Rational optimization of generic
primers used for Norwalk-like virus detection by reverse transcriptase
polymerase chain reaction. J Clin Virol. 2002 Aug;25(2):233-5. doi:
10.1016/s1386-6532(02)00126-9.
11. Herring AJ, Inglis NF, Ojeh CK, Snodgrass DR, Menzies JD. Rapid
diagnosis of rotavirus infection by direct detection of viral nucleic
acid in silver-stained polyacrylamide gels. J Clin Microbiol. 1982
Sep;16(3):473-7.
12. Koopmans M, Duizer E. Foodborne viruses: an emerging problem. Int J
Food Microbiol. 2004 Jan 1;90(1):23-41. doi:
10.1016/s0168-1605(03)00169-7.
13. Patel MM, Hall AJ, Vinjé J, Parashar UD. Noroviruses: a
comprehensive review. J Clin Virol. 2009 Jan;44(1):1-8. doi:
10.1016/j.jcv.2008.10.009.
14. Ahmed SM, Hall AJ, Robinson AE, Verhoef L, Premkumar P, Parashar
UD, Koopmans M, Lopman BA. Global prevalence of norovirus in cases of
gastroenteritis: a systematic review and meta-analysis. Lancet Infect
Dis. 2014 Aug;14(8):725-730. doi: 10.1016/S1473-3099(14)70767-4.
15. Scallan E, Hoekstra RM, Angulo FJ, Tauxe RV, Widdowson MA, Roy SL,
Jones JL, Griffin PM. Foodborne illness acquired in the United
States--major pathogens. Emerg Infect Dis. 2011 Jan;17(1):7-15. doi:
10.3201/eid1701.p11101.
16. Institut National de Santé Publique du Québec. Cas d’infection à
Caliciviridae incluant le norovirus. STATLABO-Statistiqued ’Analyse du
Laboratoire Santé Publique du Québec. INSPQ, 2011 Jan;10(1):1-12.
17. Kroneman A, Harris J, Vennema H, Duizer E, van Duynhoven Y, Gray J,
Iturriza M, Böttiger B, Falkenhorst G, Johnsen C, von Bonsdorff CH,
Maunula L, Kuusi M, Pothier P, Gallay A, Schreier E, Koch J, Szücs G,
Reuter G, Krisztalovics K, Lynch M, McKeown P, Foley B, Coughlan S,
Ruggeri FM, Di Bartolo I, Vainio K, Isakbaeva E, Poljsak-Prijatelj M,
Grom AH, Bosch A, Buesa J, Fauquier AS, Hernandéz-Pezzi G, Hedlund KO,
Koopmans M. Data quality of 5 years of central norovirus outbreak
reporting in the European Network for food-borne viruses. J Public
Health (Oxf). 2008 Mar;30(1):82-90. doi: 10.1093/pubmed/fdm080.
18. PHE. Weekly national norovirus and rotavirus report. 2014. Public
Health England 2014, 1-8.
19. Havelaar AH, Haagsma JA, Mangen MJ, Kemmeren JM, Verhoef LP, Vijgen
SM, Wilson M, Friesema IH, Kortbeek LM, van Duynhoven YT, van Pelt W.
Disease burden of foodborne pathogens in the Netherlands, 2009. Int J
Food Microbiol. 2012 Jun 1;156(3):231-8. doi:
10.1016/j.ijfoodmicro.2012.03.029.
20. National Institute of Infectious Diseases (NIID) 2014.
http://www.nih.go.jp/niid/en/iasr-noro-e.html. NIID. 2014.
21. van Beek J, Ambert-Balay K, Botteldoorn N, Eden J S, Fonager J,
Hewitt J, Iritani N, Kroneman A, Vennema H, Vinjé J, White P A,
Koopmans M, on behalf of NoroNet Collective. Indications for worldwide
increased norovirus activity associated with emergence of a new variant
of genotype II.4, late 2012. Euro Surveill. 2013;18(1):pii=20345.
https://doi.org/10.2807/ese.18.01.20345-en
22.
Peláez, D. Enfermedad diarreica aguda (EDA) nuevos agentes virales. Rev
MVZ Córdoba 2004, 9(2):470. doi:10.21897/rmvz.497.
23. Gomez K, Stupka J, Parra G, Gomez J. Caracterización molecular de
cepas de norovirus aislados de brotes de gastroenteritis ocurridos en
Argentina durante 2004. Rev Argent Microbiol 2005, 37(1):43.
24. Gomez KA, Stupka JA, Gómez J, Parra GI. Molecular characterization
of calicivirus strains detected in outbreaks of gastroenteritis in
Argentina. J Med Virol. 2007 Nov;79(11):1703-9. doi: 10.1002/jmv.20989.
25. Gomes KA, Stupka JA, Diana A, Parra GI. Caracterización molecular
de calicivirus aislados de brotes de gastroenteritis ocurridos en la
Argentina durante los años 2005 y 2006 [Molecular characterization of
calicivirus strains detected in outbreaks of gastroenteritis occurring
in Argentina during 2005 and 2006]. Rev Argent Microbiol. 2008
Oct-Dec;40(4):222-8.
26. Loutreul J, Cazeaux C, Levert D, Nicolas A, Vautier S, Le Sauvage
AL, Perelle S, Morin T. Prevalence of human noroviruses in frozen
marketed shellfish, red fruits and fresh vegetables. Food Environ
Virol. 2014 Sep;6(3):157-68. doi: 10.1007/s12560-014-9150-8.
Recibido:
2019-04-19 Aceptado: 2020-03-10
DOI:
http://dx.doi.org/10.31053/1853.0605.v77.n1.24070
©
Universidad Nacional de Córdoba