LIPASAS DE ESPECIES CÁNDIDA: UNA REVISIÓN SOBRE ASPECTOS
BIOQUÍMICOS, MOLECULARES Y PATOGÉNICOS
.
CANDIDA LIPASES: A REVIEW ON BIOCHEMICAL, MOLECULAR AND PATHOGENIC
ASPECTS
LIPASES DE CANDIDA: UMA REVISÃO SOBRE ASPECTOS BIOQUÍMICOS,
MOLECULARES E PATOGÊNICOS
Graciela del Valle Castillo1, Ana Isabel Azcurra 2, Claudia Elena Sotomayor3,4.
1 Doctora en Ciencias de la Salud. Universidad Nacional de Córdoba,
Facultad de Odontología, Departamento de Biología Bucal, Córdoba,
Argentina.
2 Doctora en Ciencias Químicas. Universidad Nacional de Córdoba,
Facultad de Odontología, Departamento de Biología Bucal, Córdoba,
Argentina.
3 Doctora en Ciencias Químicas. Universidad Nacional de Córdoba,
Facultad de Ciencias Químicas. Departamento de Bioquímica Clínica,
Laboratorio De Inmunidad Innata a Patógenos Fúngicos. Centro de
Investigaciones en Bioquímica Clínica (CIBICI)-CONICET, Córdoba,
Argentina.
4 Email de contacto:
csotomay@fcq.unc.edu.ar
Conceptos clave:
- Las lipasas secretadas por C. albicans facilitan la penetración
activa en las células y contribuyen a la invasión del tejido.
- Candida expresa diferentes genes de lipasa, dependiendo de su
localización y estadio de la infección.
- Su rol como factor de virulencia permitiría el desarrollo de nuevos
fármacos antifúngicos
Resumen:
En el último medio siglo se produjo un aumento significativo en la
incidencia de infecciones fúngicas siendo probable que se conviertan en
una prioridad de salud global. El sofisticado grado de interacción
hospedador-Candida es producto de diferentes estrategias de
virulencia que utiliza el hongo para invadir los tejidos y de los
diversos mecanismos de defensa que este último desarrolla para
controlarlo. Existe bibliografía que indica que este hongo comensal
oportunista posee componentes que pueden ser considerados factores de
virulencia asociados a la etapa del proceso infeccioso. Dentro de los
factores de virulencia de este hongo pueden mencionarse la adherencia a
las superficies celulares, la formación de biofilms y la
producción de enzimas hidrolíticas. Las hidrolasas secretadas por C. albicans más estudiadas son las aspartil proteinasas, las
fosfolipasas y las esterasas, mientras que las lipasas han sido las
menos exploradas. Estas enzimas tendrían como función facilitar la
penetración activa en las células, participar en la digestión y
síntesis de ésteres de lípidos para su nutrición y contribuir a la
invasión del tejido al hidrolizar los componentes lipídicos de las
membranas celulares del hospedador. También hay evidencia bibliográfica
que indica que estas enzimas son capaces de dañar células y moléculas
del sistema inmune para evitar la actividad antimicrobiana. Teniendo en
cuenta lo precedente, esta revisión, proporciona una actualizada
descripción de las características bioquímicas y moleculares de las
lipasas secretadas por el hongo Candida, su rol como factor de
virulencia y su potencial para el desarrollo de nuevos fármacos
antifúngicos.
Palabras clave:
lipasas; candida; terapia molecular dirigida.
Abstract:
In the last half century there was a significant increase in the
incidence of fungal infections being likely to become a global health
priority. The sophisticated degree of host-Candida interaction
is the product of different virulence strategies used by the fungus to
invade the tissues and the various defense mechanisms that it develops
to control it. There is a significant amount of literature that
indicates that this opportunistic commensal fungus has components that
can be considered virulence factors related to the stage of the
infectious process. Among the virulence factors of this fungus can be
mentioned the adherence to cell surfaces, the formation of biofilms and
the production of hydrolytic enzymes. The most studied hydrolases
secreted by C. albicans are aspartyl proteinases,
phospholipases and esterases, while lipases have been the least
studied. These enzymes would have the function to facilitate active
penetration into the cells, participating in the digestion and
synthesis of lipid esters for their nutrition and contributing to the
invasion of the tissue by hydrolyzing the lipid components of the host
cell membranes. There is also bibliographic evidence that these enzymes
are capable to damage cells and molecules of the immune system to avoid
the antimicrobial activity.Taking into account the foregoing, this
review provides an updated description of biochemical and molecular
characteristics of the lipases secreted by Candida, its role
as a virulence factor and its potential for the development of new
antifungal drugs.
Keywords:
lipases; candida;
molecular targeted therapy
Resumo:
No último meio século, houve um aumento significativo na incidência de infecções fúngicas, o que provavelmente se tornará uma prioridade de saúde global. O grau de interacção sofisticado produto hospedeiro-Candida é diferentes estratégias de virulência, utilizando o fungo para invadir tecidos e diversos mecanismos de defesa para controlar este último desenvolve. Não existe literatura que indica que este fungo oportunista comensais tem componentes que podem ser considerados factores de virulência associados com a fase de infecção. Dentro dos factores de virulência do fungo podem ser mencionados aderência a superfícies de células, a formação de biofilme e de produção de enzimas hidrolíticas. Hidrolases segregadas por C. albicans mais estudados são de aspartil proteinases, fosfolipases e esterases, enquanto que as lipases têm sido menos explorado. Estas enzimas têm a função de facilitar a penetração activa em células envolvidas na digestão, e a síntese de ésteres de lípidos para a nutrição e contribuir para a invasão de tecidos por hidrólise dos componentes lipídicos das membranas das células do hospedeiro. Há também evidência na literatura de que estas enzimas são capazes de células e moléculas do sistema imunológico para evitar danificar a actividade antimicrobiana. Face ao exposto, esta avaliação, fornece uma descrição actualizada das características bioquímicas e moleculares de lipases segregadas pelo fungo Candida, o seu papel como um factor de virulência e o potencial para o desenvolvimento de novos agentes antifúngicos.
Palavras chave: lipases; candida; terapia de alvo molecular
Introducción
El reino Fungi comprende especies que están asociadas a un amplio
espectro de enfermedades en el hombre. En el último medio siglo se
produjo un aumento significativo en la incidencia de infecciones
fúngicas asociadas a la pandemia del VIH, las terapias
inmunosupresoras, al cáncer y los trasplantes, como tambiéndebido al
aumento en el uso de dispositivos médicos como catéteres, implantes y
dispositivos intrauterinos, que eluden las barreras biológicas innatas
y sirven como plataforma para la formación de biofilm. Algunos
autores sugieren que, a medida que se avanza en estrategias que
aumenten la esperanza de sobrevida de individuos inmunocomprometidos,
es probable que esta tendencia continúe en aumento y que las
infecciones micóticas se conviertan en una prioridad de salud global (1). A pesar que en la actualidad no existen
datos epidemiológicos precisos, Candida junto a otros hongos
del género Aspergillus, Cryptococcus y Pneumocystis, son agentes causales de tantas muertes anuales
como la tuberculosis o la malaria(2). El
sofisticado grado de interacción hospedador-Candida es
producto de diferentes estrategias de virulencia que utiliza el hongo
para invadir los tejidos y de los diversos mecanismos de defensa que
este último desarrolla para controlarlo. Existe relevante cantidad de
bibliografía que indica que este hongo comensal oportunista posee
componentes que pueden ser considerados factores de virulencia y están
agrupados de acuerdo a la etapa del proceso infeccioso(3-5).
Dentro de los factores de virulencia de este hongo pueden mencionarse
la adherencia a las superficies celulares, la formación de biofilms y la producción de enzimas hidrolíticas. Las
hidrolasas secretadas por C. albicans más estudiadas son las
aspartil proteinasas, las fosfolipasas y las esterasas, mientras que
las lipasas han sido las menos exploradas(9). Estas enzimas
tendrían como función facilitar la penetración activa en las células,
participar en la digestión y síntesis de ésteres de lípidos para su
nutrición y contribuir a la invasión del tejido al hidrolizarlos
componentes lipídicos de las membranas celulares del hospedador. Existe
evidencia experimental sobre el rol de estas enzimas y sus capacidad de
de dañar células y moléculas del sistema inmune para evitar la
actividad antimicrobiana del mismo(9-12).
Esta revisión, explora y recopila información existente sobre las
características bioquímicas y moleculares de las lipasas secretadas por
el hongo Candida, su rol como factor de virulencia y su
potencial para el desarrollo de nuevos fármacos antifúngicos.
Características bioquimicas de las lipasas: estructura y función
Las lipasas fúngicas son enzimas extracelulares con características
hidrolíticas. Su actividad máxima se da a un pH 7 a las 24 horas de
cultivo y a una temperatura de 37°C. Estructuralmente presentan el
plegamiento típico de las α/β hidrolasas (α / β hydrolase fold
), que consiste en una estructura central formada por 8 láminas β
interconectadas por α-hélices (Fig. 1). El centro activo de estas
enzimas está constituido por tres aminoácidos: una serina, un ácido
aspártico o un ácido glutámico y una histidina. En medio acuoso, la
mayoría de las lipasas son activadas por la presencia de una interfase
agua / lípido, un fenómeno conocido como activación interfacial, que
implica el desplazamiento de una estructura superficial denominada tapa
o flap(8,13-16).La tapa integrada por un
bucle de péptidos α-helicoidal es una estructura anfipática; así, en la
estructura enzimática cerrada, su lado hidrofílico hace frente al
disolvente, mientras que el hidrofóbico se dirige hacia el núcleo
proteico; a medida que la enzima cambia a la conformación abierta, la
cara hidrófoba queda expuesta y contribuye a la unión del sustrato
(Fig. 2).
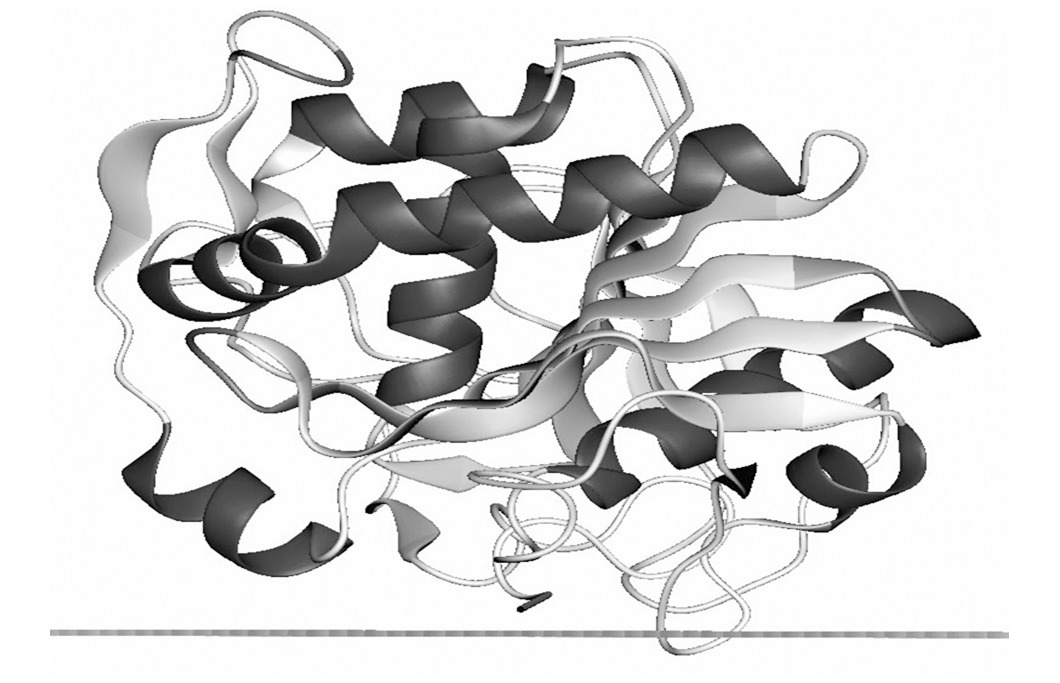
Figura N° 1. Conformación estructural de la lipasa.
En: http://opm.phar.umich.edu/protein.php?pdbid=1trh
.Orientations of proteins in membranes.
Lipasa de Candida rugosa.
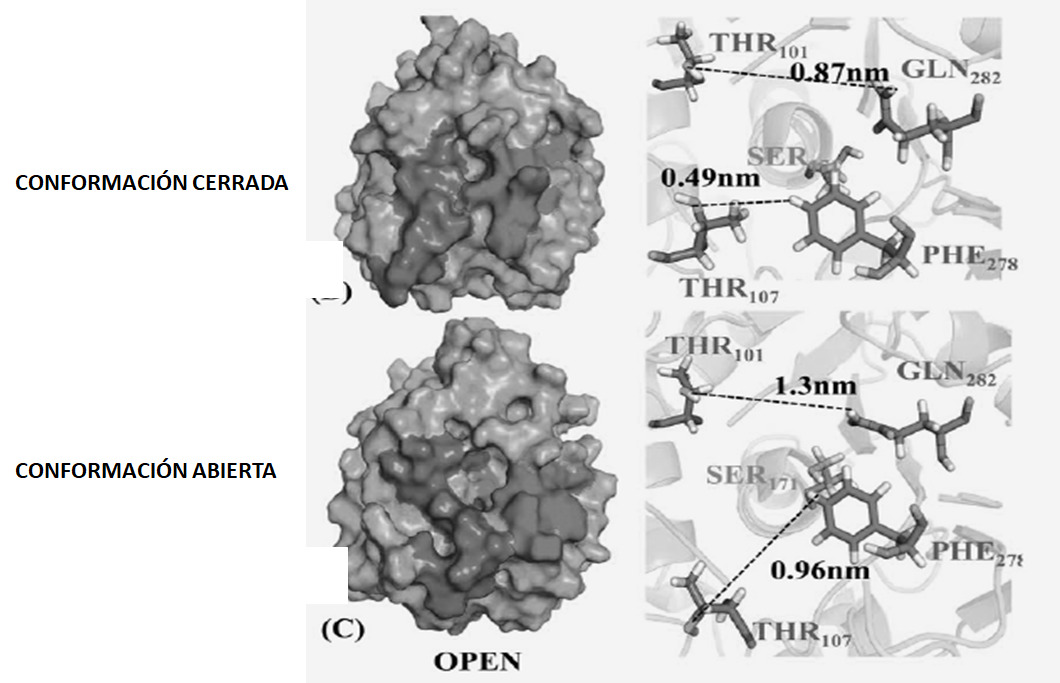
Figura N° 2. Conformación de la lipasa. Conformación cerrada
(inactiva) con el sitio activo bloqueado por una cadena
polipeptídica llamada lid, y una confomación abierta
(activa) con el lid desplazado.
De Rehm y cols.S, Trodler P, Pleiss J. Solvent-induced lid
opening in lipases: a molecular dynamics study.
Protein Sci 2010;19(11):2122-30.
Por lo tanto, no sólo la naturaleza anfipática de la tapa, sino también
su secuencia de aminoácidos específica podría ser de importancia para
la actividad y especificidad de las LIP. Se ha demostrado que la
expresión de los genes que codifican las lipasas está condicionada por
las caracteristicas de crecimiento y, en particular, por la fuente de
carbono disponible en el medio de cultivo. La comparación de las
secuencias de aminoácidos revela que la variabilidad entre las
isoenzimas se agrupa en los sitios de unión del sustrato y en la región
de la tapa, que interactúa con las moléculas del sustrato en la
conformación de la enzima abierta. Este mecanismo de activación, así
como las estructuras de las lipasas y la composición del centro activo
son altamente conservados evolutivamente(16,17).
El mecanismo catalítico de las lipasas se basa en un sistema de
intercambio de cargas que consta de cuatro etapas. Tras la unión del
sustrato, se produce el ataque nucleofílico por parte del grupo
hidroxilo de la serina sobre el enlace éster del lípido, lo que lleva a
la rotura del enlace y a la formación de un intermediario entre el
ácido graso y la serina nucleofílica. Seguidamente, se libera el
alcohol y se produce un segundo ataque nucleofílico por parte de una
molécula de agua que ataca el enlace éster del intermediario
transitorio, lo que produce la liberación del ácido graso y la
regeneración del centro catalítico13. Este proceso
catalítico tiene una doble función, ya que no sólo se generan moléculas
importantes como fuente nutricional para la sobrevida del hongo, sino
que también desempeñan un papel crítico en la invasión del hospedador
por su capacidad de ejercer daño sobre paredes celulares y tejidos (8, 18,19).
Si bien la función más prominente de las lipasas fúngicas
extracelulares es la digestión de lípidos para la adquisición de
nutrientes, otra función descripta de las lipasas es favorecer la
adherencia del microorganismo al tejido huésped y / o a las células
vecinas al degradar las moléculas de la superficie y, por lo tanto,
liberar nuevos receptores. La Figura 3 describe las características
bioquímicas y moleculares de estas enzimas y su rol fisiológico y
patogénico. Otros autores han demostrado acciones sinérgicas entre las
lipasas y las fosfolipasasdel hongo, como así también con las sap. las
lipasas disminuyen el ph del medio al liberar ácidos grasos y, de este
modo, optimizan el ph de acción de las sap secretadas, reconocidos
factores de virulencia(20). Además las lipasas
microbianas pueden tener actividades enzimáticas auxiliares, a través
de la escisión de los fosfolípidos, componentes principales de las
membranas celulares del huésped.
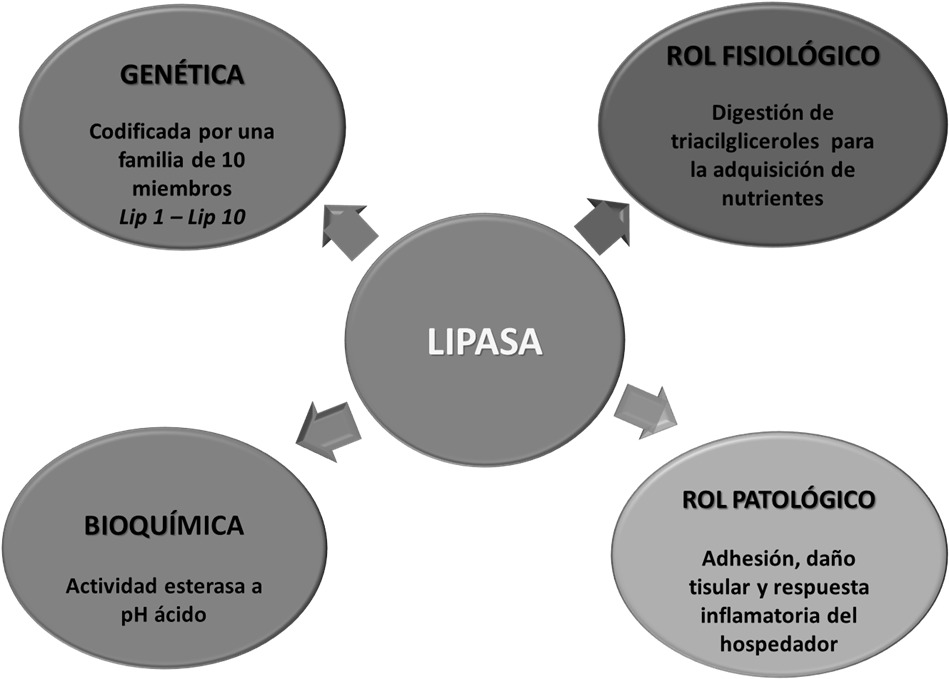
Figura N° 3. Características bioquímicas, moleculares, rol
fisiológico y patogénico de las lipasas de Candida.
Características moleculares de las lipasas
La actividad lipasa en cepas patogénicas de Candida fue
descripta por primera vez por Werner(21). En el
año 1997 se aisló el primer gen de lipasa clonado enC. albicans que se denominó Lip1( 6). Años más tarde, Hube y col reportaron la existencia de
nueve nuevos miembros de esta familia de genes de lipasas (Lip
2 a Lip10) que se clonaron y caracterizaron( 7). Posteriormente cuando Lip1 y Lip8 se
usaron como sonda contra el ADN genómico de C.albicans en un
análisis por Southernblot, se observaron varias bandas de
hibridización, respaldando la existencia de genes similares en este
hongo(22).
Otras especies de Candida médicamente relevantes presentan
secuencias de ADN homólogas a las de C. albicans; así mientras
se detectaron dos bandas en C. parapsilosis yC. tropicalis, no se identificaron secuencias similares en C. krusei y C. glabrata, mientras que se reportaron
al menos cinco secuencias en el genoma de C. dubliniensis(22). Esta es la primera evidencia de que C. dubliniensis puede tener una familia de genes de lipasa que
está altamente relacionada con la de C. albicans.
Los genes de las lipasas se encuentran en cuatro cromosomas diferentes:
1, 6, 7 y R (cromosoma de mayor tamaño del genoma de C. albicans) y según sus homologías en el nivel de
aminoácidos, es posible dividir la familia de las lipasas en tres
subgrupos. El primer subgrupo está conformado por las lipasas 1,2,3,6 y
10 ya que muestran similitud de al menos un 74%. El segundo grupo lo
integran las lipasas 4,5, 8 y 9 con una similitud de al menos un 68%.
Los miembros del primer subgrupo se encuentran codificados en el
cromosoma 1, mientras que los del segundo grupo están situados en el
cromosoma 7, excepto lipasa 4, codificada en el cromosoma 6. La lipasa
7 forma un grupo propio ya que muestra la mayor divergencia del resto
de la familia y es el único gen codificado en el cromosoma R. La
información disponible sugiere que existieron y se duplicaron al menos
dos ancestros de genes de lipasa. También se ha sugerido la presencia
de una alta flexibilidad genética(23); esta
amplia gama de reordenamientos cromosómicos le permite al hongo hacer
frente a los diferentes condiciones, lo que sugiere que la expresión de
una familia de genes de lipasas es un mecanismo de adaptación de C. albicans a su hospedador. Luego de la identificación
completa de esta familia, surgió el interrogante acerca de si cada
miembro es transcripcionalmente activo y si a su vez podría haber una
regulación diferencial(24).
Se han reportado secuencias similares a lipasa 1 a lipasa 10 en otras
especies de Candida patógenas como C. tropicalis, C. parapsilosis y C. krusei, pero no
en C. glabrata(25). De igual manera, en C.rugosa se ha descripto la existencia de cinco isoenzimas de
lipasas(26-28).
El primer informe que sugirió la presencia de lipasas secretadas enC. parapsilosis fue publicado por Fu y cols. (10). Cinco años después, Neugnoty cols. ( 29) identificaron dos ORFs que codifican a la lipasa en esta
especie. La comparación de la secuencia de aminoácidos reveló que estas
proteínas identificadas podrían pertenecer a la misma familia de genes
de lipasa de C. albicans descriptas por Hube y colaboradores (7), por lo tanto, también podrían estar
involucrados en la patogenia de las infecciones fúngica, debido a que
los ORF que codifican a la lipasa de C. parapsilosis presentan
homología más alta con LIP1 de C.albicans. En consecuencia,
los ORFs fueron nombrados CpLIP1 y CpLIP2(30). El
análisis de la expresión de estos genes reveló que sólo CPLIP2 es
funcional, y con un sitio catalítico común en las enzimas hidrolíticas
formado por Gly – X – Ser – X - Gly y que se encuentra altamente
conservado(29).
Lipasas como factor de virulencia
Las lipasas no sólo cumplen funciones biológicas de nutrición y
digestión, como la obtención de nutrientes y el aprovechamiento de
fuentes de carbono, sino que además desempeñan un papel crítico en la
invasión del hospedador(8,18,19). Así, las
lipasas secretadas por las especies Candida están asociadas
con la adhesión a la célula del hospedador y al daño tisular (31) y a la inducción de respuestas inflamatorias
del hospedador(7,30,32). Se oservó que de los 10
genes caracterizados existe una expresión diferencial durante la
colonización en modelos experimentales y en muestras de pacientes y que
está ampliamente influenciada por la etapa de la infección y por el
sitio de colonización(7,22,33), por lo
que algunos de estos genes se expresan constitutivamente y otros son
regulados por el ambiente(34). Los estudios
realizado usando un modelo de infección en mucosa gástrica y
orofaringea de ratón mostraron que mientras los genes Lip4 y Lip8 se expresaron tempranamente en muestras de estómago,
paladar, esófago y lengua, la expresión de Lip1, Lip3 y Lip9 se observada sólo en tejido gástrico y es indetectables
en mucosa bucal al igual que la Lip2(35)
. Otro estudio realizado en ocho pacientes con candidiasis bucal
también reportó una expresión diferencial; mientras que Lip1 y Lip9 se expresaron en todas las muestras, indicando asociación
al nicho colonizado, Lip10 no fue detectado y los transcriptos Lip4, Lip5 y Lip8 se detectaron en el 50% de
las muestras(34).
La evidencia científica asocia a estas lipasas como factores de
virulencia en determinadas patologías(36).
Distintos estudios realizados evidencian el rol de las lipasas como
factor de virulencia de Candida (Tabla 1). Paraje y
cols., empleando una lipasas purificada de C. albicans,
aportaron importante evidencia sobre el efecto directo de esta lipasas
sobre las células del sistema inmune y células parenquimales del
hospedador. También reportaron la capacidad de esta lipasas de
inducirla producción de elevadas concentraciones de compuestos tóxicos
de oxigeno y apoptosis celular(10,11). Park y
cols.reportaron la expresión de todas las lipasas durante la transición
de la morfología de levadura a hifa; también detectaron los
transcriptos de Lip5, Lip6, Lip8 y Lip9 durante infecciones experimentales, evidenciando el rol
de esta enzima en la virulencia y persistencia de la micosis (37). En un modelo murino de candidiasis
diseminada, empleando C. albicans mutante Lip8 Δ / Δ,
no se observó infección hepática ni mortalidad en comparación con la
infección con la cepa parental, donde la mortalidad fue del 55 al 70%,
lo que demuestra claramente que LIP8 es un factor clave de virulencia
durante la infección(38,39).
El uso de cepas mutantes de C.parapsilosis con deleción de los
genes Lip1 y Lip2 en modelos in vitro e in vivo de infección, reveló una disminución en la virulencia
de la cepa y cambios en la complejidad y arquitectura de su biofilm comparados con la cepa parental. A su vez, estas cepas
mostraron bajos niveles de LDH (enzima láctico dehidrogenasa) marcadora
de daño celular cuando se inoculó epitelio oral humano reconstituido(38,39). Además, esta cepa mutante de C. parapsilopsis CpΔΔLip1 − ΔΔLip2 durante
su interacción con macrófagos murinos y humanos evidenció la alteración
de las funciones en estas células fagocíticas, confirmando así que las
lipasas secretadas por el hongo desempeñan un papel clave en las etapas
tempranas de las interacciones hospedador-patógeno( 30). Otros estudios realizados en un modelo de ratas
neonatales infectadas con C. albicans y C. parapsilopsis con mutaciones en esta enzima, empleando las
vías intraperitoneal, gástrica y endovenosa mostraron bajos niveles de
carga fúngica en hígado, bazo y riñón y por lo tanto una menor
patogenicidad(36).
|
Tabla N° 1: Lipasas como factor de virulencia
|
|
Modelo animal
|
Estudios in vitro
|
Estudios en
|
Hallazgos
|
Referencia
|
|
humanos
|
|
Candidiasis diseminada
|
|
|
-Expresión diferencial de genes
|
Stehr et al, 2004;
|
|
de LIP en tejidos y estadios
|
Schofield et al, 2005
|
|
de la infección
|
|
|
|
Pacientes con candidiasis bucal
|
Expresión diferencial de genes Lip en ocho
pacientes con candidiasis bucal
|
Stehr et al, 2004
|
|
|
Macrófagos de rata
|
|
-Citotoxicidad y apoptosis dosis dependiente.
|
Paraje at al, 2008
|
|
Hepatocitos de rata
|
Daño celular y apoptosis.
|
|
-Depósitos lipídicos intracitoplasmáticos.
|
|
Tejido humano oral reconstituido
|
|
Inducción de respuesta inflamatoria.
|
Trofa et al, 2009
|
|
|
|
-Sobreexpresión de iNOS y elevada producción
|
Paraje et al, 2009
|
|
Macrófagos de rata
|
de NO en macrófagos sin activar.
|
|
- Activación de la vía de la arginasa en macrófagos
|
|
activados, promoción de perfil M2
|
|
Candiadisis diseminada Modelo en ratas neonatas
|
|
|
Contribución de las lipasas de C. albicans y C. parapsilosisa la
virulencia.
|
|
|
Trofa et al, 2011
|
|
|
Pacientes con cáncer bucal
|
-Aumentada producción de LIP respecto a
|
Castillo et al, 2018
|
|
aislados clínicos de Candida residentes en
|
|
la cavidad bucal de individuos sanos.
|
|
Fibroblastos gingivales humanos
|
|
Inducción de daño celular.
|
Castillo, 2017
|
|
Macrófagos humanos
|
|
Alteración de funciones fagocíticas.
|
Tóth et al, 2015
|
|
Macrófagos de rata
|
Lipasas como diana para el diseño de fármacos
La terapia antifúngica sigue siendo un desafío; actualmente el manejo
clínico se ve seriamente comprometido por el aumento en el número de
micosis oportunistas, por los efectos secundarios de los antimicóticos y
sobre todo por la aparición de una creciente resistencia a los fármacos
antifúngicos que, especialmente en el género Candida (40). En este marco, muchas líneas de investigación han centrado
sus estudios en hallar nuevas estrategias para el tratamiento de estas
micosis a través del estudio de los factores de virulencia menos
investigados ya que podrían representar blancos para el desarrollo de
nuevos fármacos antifúngicos. Considerar a las lipasas como un factor
revelante en la virulencia del hongo abre nuevos perspectivas terapéuticas.
Uno de los fármacos de uso masivo por la población por sus múltiples
acciones farmacológicas en la aspirina. Estudios recientes realizados sobre
factores de virulencia han propuesto a la aspirina o ácido acetilsalicílico
como una alternativa de tratamiento por afectar y suprimir la formación debiofilm de especies Candida in vitro(41,42). Experiencias realizadas in vitro con C. albicans y C. parapsilosis demuestran que al ácido
acetil salicílico, es además un potente inhibidor de lipasas( 36). Estos autores reportaron la disminución del crecimiento
fúngico y protección contra el daño tisular producido por las especies de Candida por efecto de inhibidores de la LIP, como la quinina y el
ebelactona B.
Nuestros aportes experimentales
En nuestro laboratorio se evaluó la actividad de las lipasas en cepas
patogénicas de especies Candida aisladas de pacientes con lesiones
bucales: líquenes atípicos, lesiones malignas (carcinoma bucal de células
escamosas), candidiasis crónica y de mucosa sana. Interesantemente todos
los aislados clínicos de lesiones presentaron actividad lipasa, pero no así
en los provenientes de controles sanos en los que no se detectó actividad
lipasa. Cabe destacar que los aislados de cáncer bucal mostraron una mayor
actividad lipasa, comparada con los aislados de otras lesiones bucales,
indicando un mayor potencial patogénico(43). Si bien
no existen otros trabajos publicados que exploren estos aspectos, Pereira y
cols.(44) observaron una asociación entre el grado de
lesión de candidiasis bucal y la expresión de la virulencia de Candida. Nuestro trabajo y el reporte mencionado aportan nueva
evidencia a la controversia existente entre la presencia de Candida y cancerización de una lesión, lo que enfatiza la
necesidad del estudio conjunto de la múltiple y compleja interacción entre
el hospedador y este hongo(44).
En concordancia con estos hallazgos, al estudiar la expresión de genes de
lipasas de C.albicans en pacientes con lesiones estomatológicas y
de mucosa sana, observamos que la sobreexpresión de los transcriptos de los
genes de lipasas fue diferencial según las distintas lesiones
incluidas en nuestros estudios. Encontramos una significativa ausencia del
transcripto Lip3 en los aislados sin lesión y una mayor frecuencia
del transcripto Lip8 en las cepas aisladas de pacientes con cáncer
bucal(43) en acuerdo con la alta patogenicidad
reportada por otros autores(39,45).
Al evaluar el efecto del ácido acetilsalicílico sobre la actividad lipasa
en cultivos de fibroblastos humanos expuestos a C. albicans
provenientes de diferentes lesiones estomatológicas, observamos diferencias
significativas en los niveles de inhibición en las lipasas producidas por
los distintos aislados clínicos. Una mayor concentración de ácido acetil
salicílico fue necesaria para inhibir la actividad lipolítica de los
aislados de cáncer bucal comparado con líquenes y candidiasis crónica, lo
que refuerza el concepto de la habilidad de hongo de adaptarse a los
diferentes entornos y condiciones en cada tipo de lesiones, en acuerdo con
Pereira y cols.(44). Significativamente nuestro
hallazgos evidencian que, entre las lesiones estudiadas, los aislados
provenientes de cáncer bucal se destacaron por la sobreexpresión de un
perfil particular transcriptos de lipasas de C. albicans, a una mayor actividad lipolítica y a una mayor
concentración de ácido acetil salicílico necesaria para su inhibición.
Además, en estudios efectuados en cultivos primarios de fibroblastos
gingivales humanos pudimos establecer mediante el uso deinhibidores
específicos, que las lipasas de C.albicans son capaces de provocar daño celular. Interesantemente la injuria provocada fue
mayor cuando los aislados del hongo fueron recuperados de pacientes con
cáncer bucal comparado con aislados clínicos de pacientes sin lesión( 43). Estos resultados en su conjunto aportan nueva e importante
información sobre el rol de estas enzimas, su contribución en la patogenia
del proceso infeccioso en pacientes y propone alternativas de tratamiento.
Conclusiones finales
El papel de las lipasas en los procesos de invasión y persistencia de la
infección por Candida queda evidenciado por su comportamiento
adaptativo según el nicho y el estrés que el ambiente le ocasiona. La
diferente virulencia, patogenicidad y perfil genético de Candida
según su procedencia refuerzan la necesidad del control de este patógeno
comensal cuando sobre-infecta lesiones, considerando su discutido rol como
promotor de la carcinogénesis. Además, el conocimiento de este factor de
virulencia abre nuevas posibilidades en la terapéutica antimicótica.
Financiación
Este trabajo ha sido financiado por la Agencia Nacional de Promoción
Científica y Tecnológica-FONCyT (N° PICT-2015-1393); Secretaría de Ciencia
y Tecnología-SECyT-UNC (N° 30720150100934CB y 30720150100925CB) y el
Consejo Nacional de Investigaciones Científicas y Técnicas-CONICET (N°
PIP-112 201501 00652 CO).
Conflictos de interés
No existen conflictos de interés.
Bibliografía
1- Miró MS, Vigezzi C, Rodriguez E, Icely PA, Caeiro JP, Riera F, et
al.
Innate receptors and IL-17 in the immune response against human
pathogenic fungi. Rev Fac Cien Med Univ Nac Cordoba. 2016;73(3):188-96.
2- Moyes DL, Richardson JP, Nageli JR. Candida albicans-épithélial
interactions and pathogenicity mechanisms: scratching the surface.
Virulence. 2015;6(4):338-46.
3- Whiteway M, Bachewich C. Morphogenesis in Candida albicans. Annu Rev
Microbiol. 2007; 61:529–53.
4- Cheng SC, Joosten LAB, Kullberg BJ, Netea MG. Interplay between
Candida albicans and the mammalian innate host defense. Infect Immun.
2012; 80:1304–13.
5- Singh A, Verma R, Murari A, Agrawal A. Oral candidiasis: An
overview. J Oral Maxillofac Pathol. 2014;1 (Suppl 1):S81–5.
6- Fu Y, Ibrahim AS, Fonzi W, Zhou X, Ramos CF, Ghannoum MA. Cloning
and characterization of a gene (LIP1) which encodes a lipase from the
pathogenic yeast Candida albicans. Microbiology. 1997; 143:331–40.
7- Hube B, Stehr F, Bossenz M, Mazur A, Kretschmar M, Schäfer W.
Secreted lipases of Candida albicans: cloning, characterisation and
expression analysis of a new gene family with at least ten members.
Arch Microbiol. 2000; 174(5):362-74.
8- Schaller M, Borelli C, Korting HC, Hube B. Hydrolytic enzymes as
virulence factors of Candida albicans. Mycoses. 2005; Nov; 48
(6):365-77.
9- Staniszewska M, Bondaryk M, Piłat J, Siennicka K, Magda U,
Kurzatkowski W. Virulence factors of Candida albicans. Przegl
Epidemiol. 2012; 66(4):629-33.
10- Paraje MG, Correa SG, Renna MS, Theumer M, Sotomayor CE. Candida
albicans-secreted lipase induces injury and steatosis in immune and
parenchymal cells. Can J Microbiol. 2008; 54(8):647-59.
11- Paraje MG, Correa SG, Albesa I, Sotomayor CE. Lipase of Candida
albicans induces activation of NADPH oxidase and L-arginine pathways on
resting and activated macrophages. Biochem Biophys Res Commun.
2009;390(2):263-8.
12- Castillo GDV, Blanc SL, Sotomayor CE, Azcurra AI. Study of
virulence factor of Candida species in oral lesions and its association
with potentially malignant and malignant lesions. Arch Oral Biol.
2018;91:35-41.
13- Brocca S, Secundo F, Ossola M, Alberghina L, Carrea G, and Lotti M.
Sequence of the lid affects activity and specificity of Candida rugose
lipase isoenzymes. Protein Sci. 2003; 12(10): 2312–9.
14- Gupta R, Gupta N, Rathi, P. Bacterial lipases: An overview of
production, purification and biochemical properties. Applied
Microbiology and Biotechnology. 2004;64:763–81.
15- Lan D, Hou S, Yang N, Whiteley C, Yang B, Wang Y. Optimal
Production and Biochemical Properties of a Lipase from Candida
albicans. Int J Mol Sci. 2011; 12(10): 7216-37.
16- Khan FI, Lan D, Durrani R, Huan W, Zhao Z, Wang Y.The Lid Domain in
Lipases: Structural and Functional Determinant of Enzymatic
Properties.Front Bioeng Biotechnol. 2017;9:16.
17- Schmid RD, Verger R. Lipases: Interfacial Enzymes with Attractive
Applications. Angewandte Chemie International Edition.1998; 37:1608-33.
18- Ghannoum MA. Potential role of phospholipases in virulence and
fungal pathogenesis. Clin Microbiol Rev. 2000; 13(1):122-43.
19- Borst A, Fluit AC. High levels of hydrolytic enzymes secreted by
Candida albicans isolates involved in respiratory infections. J Med
Microbiol. 2003; 52(Pt 11):971-4.
20- Jaeger KE, Wohlfarth S. Microbial lipases from versatile tools for
biotechnology and bioengineering.1993;9: 39-46
21- Werner H. Studies on the lipase activity in yeasts and yeast-like
fungi. Zentralbl Bakteriol Orig. 1966; 200(1):113-24.
22- Stehr F, Kretschmar M, Hube B. Microbial lipases as virulence
factors. Journal of molecular catalysis B: enzymatic. 2003; 22.347-55.
23- Slutsky B, Staebell M, Anderson J, Risen L, Pfaller M, Soll DR.
White–opaque transition: a second high-frequency switching system in
Candida albicansJ. Bacteriol .1987;189-97.
24- Rustchenko EP, Howard DH, Sherman F. Variation in assimilating
functions occurs in spontaneous Candida albicans mutans having
chromosomal alterations. Microbiology.1997;143:1765-78.
25- Sónia Silva M, Negri M, Henriques R, Oliveira D, Williams J.Candida
glabrata, Candida parapsilosis and Candida tropicalis: biology,
epidemiology, pathogenicity and antifungal resistance FEMS Microbiology
Reviews.2012; 288–305.
26- Haynes K. Virulence in Candida species. Trends Microbiol.
2001;9(12):591-6.
27- López N, Pernas MA, Pastrana LM, Sánchez A, Valero F, Rúa
ML.Reactivity of pure Candida rugosa lipase isoenzymes (Lip1, Lip2, and
Lip3) in aqueous and organic media. Influence of the isoenzymatic
profile on the lipase performance in organic media.Biotechnol Prog.
2004; 20(1):65-73.
28- Domínguez de María P, Sánchez-Montero JM, Sinisterra JV, Alcántara
AR.
Understanding Candida rugosa lipases: an overview. Biotechnol Adv.
2006;24(2):180-96
29- Neugnot V, Moulin G, Dubreucq E, Bigey F. The
lipase/acyltransferase from Candida parapsilosis: molecular cloningn
and characterization of purified recombinant enzymes. Eur. J.
Biochem.2002;269(6),1734-45.
30- Tóth R, Alonso M, Bain JM, Vágvölgyi C ErwigLP and Gácser A.
Different Candida parapsilosis clinical isolates and lipase deficient
strain trigger an altered cellular immune response. Front. Microbiol.
2015; 6:1102.
31- Christensen SA, Kolomiets MV. The lipid language of plant-fungal
interactions.Fungal Genet Biol. 2011; 48(1):4-14.
32- Trofa D, Agovino M, Stehr F, Schäfer W, Rykunov D, Fiser A, et al.
A. Acetylsalicylic acid (aspirin) reduces damage to reconstituted human
tissues infected with Candida species by inhibiting extracellular
fungal lipases. Microbes Infect. 2009; 11(14-15):1131-9.
33- Schaller M, Zakikhany K, Naglik JR, Weindl G, Hube B. Models of
oral and vaginal candidiasis based on in vitro reconstituted human
epithelia. Nat Protoc. 2006; 1(6):2767-73.
34- Stehr F, Felk A, Gácser A, Kretschmar M, Mähnss B, Neuber K, et al.
Expression analysis of the Candida albicans lipase gene family during
experimental infections and in patient samples. FEMS Yeast Res. 2004;
4(4-5):401-8.
35- Schofield DA, Westwater C, Warner T, Balish E. Differential Candida
albicans lipase gene expression during alimentary tract colonization
and infection. FEMS Microbiol Lett. 2005; 244(2):359-65.
36- Trofa D, Soghier L, Long C, Nosanchuk JD, Gacser A, Goldman DL. A
rat model of neonatal candidiasis demonstrates the importance of
lipases as virulence factors for Candida albicans and Candida
parapsilosis. Mycopathologia. 2011; 172 (3):169-78.
37- Park M, Do E, Jung W. Lipolytic Enzymes Involved in the Virulence
of Human Pathogenic Fungi. Mycobiology. 2013; 41 (2):67-72.
38- Gacser A, Trofa D, Schafer W, Nosanchuk JD. Targeted gene deletion
in Candida parapsilosis demonstrates the role of secreted lipase in
virulence. J. Clin. Invest. 2007 ; 117(10) :3049-58.
39- Toth R, Tot A, Vagvölgyi C, Gacser A.Candida parapsilosis Secreted
Lipase as an Important Virulence Factor. Current Protein and Peptide
Science, 2017; 18: 1-7.
40- Cowen LE, Sanglard D, Howard SJ, Rogers PD, Perlin DS. Mechanisms
of Antifungal Drug Resistance. Cold Spring Harb Perspect Med. 2014; 5
(7):a019752.
41- Stepanovic S, Vukovic D, Jesic M, Ranin L .Influence of
acetylsalicylicacid (aspirin) on biofilm production by Candida species
Florence, Italy. Journal of Chemotherapy. 2004; 16 pp. 134–138.
42- Al-Bakri AG, Othman G, Bustanji Y. The assessment of the
antibacterial and antifungal activities of aspirin, EDTA and
aspirin–EDTA combination and their effectiveness as antibiofilm agents.
Journal of Applied Microbiology. 2009; 107: 280–6.
43- Castillo GDV, Aguilar JJ, Azcurra AI, Sotomayor CE.
Expresión a nivel molecular de las lipasas de C. albicans asociadas a
lesiones estomatólogicas crónicas, potencialmente malignas y malignas
de la cavidad bucal. En prensa, 2019.
44- Pereira CA, Domingues N, Araújo MI, Junqueira JC, Back-Brito GN,
Jorge AO.
Production of virulence factors in Candida strains isolated from
patients with denture stomatitis and control individuals. Diagn
Microbiol Infect Dis. 2016; 85:66-72.
45- Gácser A, Stehr F, Kröger C, Kredics L, Schäfer W, Nosanchuk J D.
Lipase 8 Affects the Pathogenesis of Candida albicans.Infect Immun.
2007; 75(10): 4710–8.
Recibido:
2019-03-27 Aceptado: 2019-04-14
DOI:
http://dx.doi.org/10.31053/1853.0605.v76.n2.23822