VALIDACIÓN DE UN MÉTODO INMUNOLÓGICO PARA LA DETERMINACIÓN DE
VANCOMICINA EN LÍQUIDO CEFALORRAQUÍDEO.
VALIDATION OF A IMMUNOASSAY FOR THE DETERMINATION OF VANCOMYCIN IN
CEREBOSPINAL FLUID.
Lucrecia Marks1,5, Solange Duchein2, Isabel
Inés González1,3, Hector Andrés Suárez1,3,
Susana Rivolta1,4.
1. Hospital de Niños de la Santísima Trinidad, Laboratorio.
Córdoba, Argentina.
2. Fundación Lennox, Laboratorio. Córdoba, Argentina.
3. Universidad Nacional de Córdoba, Facultad de Ciencias Químicas,
Departamento de Farmacología. Córdoba, Argentina.
4. Universidad Nacional de Córdoba, Facultad de Ciencias Médicas,
Escuela de Salud Pública. Córdoba, Argentina.
5. Email de contacto:
marks.lucrecia@gmail.com
Conceptos clave:
Si bien algunos autores internacionales han validado métodos para la
determinación de vancomicina en líquido cefalorraquídeo, son pocos los
que lo han realizado para métodos inmunológicos.
El aporte de este trabajo radica en la posibilidad de ofrecer una nueva
herramienta para el monitoreo de los niveles de vancomicina en líquido
cefalorraquídeo en pacientes críticos con infecciones graves a nivel
del sistema nervioso central, permitiendo ajustar la dosis del
antibiótico y así, mejorar la eficacia terapéutica y disminuir el
riesgo de efectos tóxicos.
Resumen:
Introducción: La vancomicina (VAN) es un antibiótico utilizado para el
tratamiento de infecciones graves. Su uso está relacionado con efectos
adversos como hiperemia facial aguda, nefrotoxicidad y ototoxicidad. Al
tener un rango terapéutico muy estrecho, el monitoreo terapéutico
resulta necesario para maximizar la eficiencia y minimizar los efectos
tóxicos. Se estima que su concentración en líquido cefalorraquídeo
(LCR) es, aproximadamente, un 10% de la plasmática en pacientes que
reciben tratamiento endovenoso del mismo y que presentan inflamación de
las meninges. Las concentraciones plasmáticas de VAN no son un
indicador confiable de las presentes en LCR. El objetivo de este
trabajo fue validar un método inmunológico basado en la interacción
cinética de micropartículas en solución (KIMS) para la determinación de
VAN en LCR. Materiales y Métodos: Se validó el método KIMS para la
valoración de VAN en LCR. Para ello, se determinaron los parámetros de
linealidad, precisión, exactitud, límite de detección, límite de
cuantificación, interferencia, selectividad y especificidad.
Resultados: el método fue lineal en un intervalo entre 0 y 15 µg/mL,
los CV% obtenidos oscilaron entre 0,7 y 2,5% en el rango lineal. Los
LOD y LOQ fueron 0,4 µg/mL y 1,4 µg/mL respectivamente. La ecuación de
la recta obtenida en base a la correlación de métodos entre KIMS y
HPLC-UV fue y= 0,9151x + 1,1695, R²=0,9453. Conclusión: El método KIMS
demostró tener una sensibilidad y especificidad apropiadas para la
determinación de VAN en LCR y, ser una herramienta útil para el
monitoreo de pacientes que presenten infecciones complicadas a nivel
del SNC.
Palabras claves:
vancomicina; líquido cefalorraquídeo; inmunoensayo; monitoreo
de drogas.
Abstract:
Introduction: Vancomycin (VAN) is an antibiotic used to treat serious
infections. Its use is related to adverse effects such as acute facial
hyperemia, nephrotoxicity and ototoxicity. By having a very narrow
therapeutic range, its monitoring is necessary to maximize efficiency
and minimize toxic effects. It is estimated that its concentration in
cerebrospinal fluid (CSF) is approximately 10% of the plasma level in
patients who receive intravenous treatment and who have meninges
inflammation. Plasma concentrations of VAN are not a reliable indicator
of those present in CSF. The aim of this study was to validate an
immunological method based on the kinetic interaction of microparticles
in solution (KIMS) for the determination of VAN in CSF. Materials and
Methods: KIMS was validated for the evaluation of VAN in CSF. For this,
the parameters of linearity, precision, accuracy, limit of detection,
limit of quantification, interference, selectivity and specificity were
determined. Results: The method was linear in a range between 0 and 15
µg/mL, the CV% obtained oscillated between 0.7 and 2.5% on the linear
range. The LOD and LOQ were 0.4 µg/mL and 1.4 µg/mL respectively. The
equation of the line obtained based on the correlation of methods
between KIMS and HPLC-UV was y = 0.9151x + 1.1695, R² = 0.9453.
Conclusion: The KIMS method demonstrated to have an adequate
sensitivity and specificity to determine VAN in CSF and being a useful
tool for monitoring patients who present complicated infections at CNS
level.
Keywords: vancomycin; cerebrospinal fluid; immunoassay; drug
monitoring.
Introducción
La Vancomicina (VAN) es un glucopéptido tricíclico antibiótico,
utilizado para el tratamiento de infecciones graves causadas por
bacterias Gram positivas multirresistentes, particularmente, organismos
meticilino-resistentes como Staphylococcus aureus (MRSA), también
utilizada en pacientes alérgicos a los antibióticos β-lactámicos. Su
efecto bactericida consiste en la inhibición de la síntesis de la pared
celular mediante la unión a las terminales D-alanil-D-alanina en la
cadena de peptidoglicano. El perfil farmacocinético de VAN es complejo
y puede ser caracterizado por modelos de uno, dos o tres
compartimentos. Posee una pobre absorción luego de la administración
oral, por lo tanto, debe ser administrada de forma parenteral para la
terapia de infecciones sistémicas. La vida media en pacientes con
función renal normal es aproximadamente 6hs. Un 30% de la dosis se une
a proteínas plasmáticas(1), el 80-90% es eliminado sin
cambios por filtración glomerular dentro de las 24hs luego de la
administración de una única dosis(2-3). Su uso está
frecuentemente relacionado con efectos adversos como hiperemia facial
aguda, nefrotoxicidad y ototoxicidad. Al tener un rango terapéutico muy
estrecho, el monitoreo terapéutico resulta necesario para maximizar la
eficiencia y minimizar los efectos tóxicos(4). Los niveles
plasmáticos deben ser determinados en condiciones de
estado-estacionario, aproximadamente antes de la cuarta dosis. La
concentración plasmática mínima debe ser mayor a 10 µg/mL para evitar
el desarrollo de resistencia bacteriana; el pico de concentración luego
de 1 hora de la infusión debe encontrarse entre 20-40 µg/mL. El
monitoreo de VAN es recomendado en pacientes que reciben dosis altas,
en aquellos que poseen alto riesgo de toxicidad, en los que tienen una
función renal alterada y en los casos en el que el tiempo de
tratamiento es prolongado.
El ingreso de drogas al líquido cefalorraquídeo (LCR) desde la sangre
es regulada por la barrera hemato-encefálica (BHE). La penetración de
drogas al epitelio coroidal, y su distribución dentro del LCR, está
influenciada por la inflamación de ésta. Algunos medicamentos también
tienen la capacidad de alterar la permeabilidad de la BHE y, de esta
manera, permitir el ingreso de VAN al LCR. Se estima que la
concentración en LCR de este antibiótico es aproximadamente un 10% de
la concentración plasmática en pacientes que presentan inflamación de
las meninges. Los cambios en la concentración de VAN en el LCR ocurren
más lentamente que en la sangre y, por lo tanto, el pico máximo de
concentración es retardado respecto al plasma. Debido a que la relación
entre la concentración de droga y el tiempo en el plasma no es paralela
a la que ocurre en el LCR, las concentraciones plasmáticas de VAN no
son un indicador confiable de las concentraciones en LCR durante el
intervalo de dosis(5).
Luego de una administración sistémica de VAN es muy difícil conseguir y
mantener concentraciones elevadas dentro del LCR ventricular. La
administración directa de pequeñas dosis de VAN directamente en el LCR
permite obtener concentraciones altas de la droga en él. Existe una
gran cantidad de condiciones que pueden alterar el volumen de
distribución y la depuración de VAN en el SNC, la acumulación en el LCR
puede ocurrir en pacientes con enfermedades que alteren la dinámica
convencional de este, o bien, que disminuya la depuración de la droga
en él.
Si bien no se han realizado estudios prospectivos para determinar el
rango terapéutico de VAN en LCR, el objetivo es mantener las
concentraciones de ésta por encima de la concentración inhibitoria
mínima (CIM) del microorganismo infectante; algunos autores identifican
las “concentraciones deseadas” en un rango de concentración en valle
entre 5 y 20 µg/mL(6). Numerosos autores han estudiado la
concentración de VAN en el LCR encontrando valores muy diversos de
acuerdo con la vía de administración, patología del paciente, la dosis
y el tiempo de toma de muestra; en este sentido, el rango de
concentraciones hallado va desde 0,3 a 187,3 µg/ml(7-8). Las
defensas del organismo en el SNC son relativamente menores que en otros
sitios del organismo, por lo que la actividad bactericida de VAN en el
LCR dentro de los ventrículos es crítica para la rápida esterilización
de éste. Concentraciones sub-terapéuticas de VAN están asociadas con
una colonización bacteriana persistente. A su vez, concentraciones
elevadas en el LCR pueden estar asociadas con neurotoxicidad, por lo
que su concentración debería ser determinada. Esto permitiría ajustar
el esquema terapéutico para mantener las concentraciones de VAN en LCR
dentro del rango terapéutico eficiente(9).
Se han desarrollado varios métodos para la determinación de VAN en
fluidos biológicos, entre ellos se encuentran métodos inmunológicos
como inmunopolarización de fluorescencia (FPIA), inmunoensayo
enzimático homogéneo (EMIT) y radioinmunoensayo (RIA); y métodos
cromatográficos. VAN ha sido cuantificada en suero y plasma utilizando
métodos de cromatografía líquida de alta resolución con detección
ultravioleta (HPLC-UV), de fluorescencia, electroquímica y
espectrometría de masas(10).
Disponer de un método inmunológico, validado en nuestro nosocomio, para
la determinación de la concentración de VAN en LCR, brinda la
posibilidad de ajustar la dosis en base a concentraciones del fármaco
libre, fracción responsable del efecto biológico directo. Esta
información, permitiría optimizar el tratamiento de pacientes con
infecciones severas a nivel del SNC, mejorando así su pronóstico y
disminuyendo el riesgo de los posibles efectos adversos producidos por
este antibiótico.
El objetivo del presente trabajo consiste en validar un método
inmunológico basado en la interacción cinética de micropartículas en
solución (KIMS) para la determinación de VAN en LCR..
Materiales y métodos
El presente estudio se realizó en el Laboratorio de Toxicología del
Hospital de Niños de la Santísima Trinidad durante el período de marzo
a octubre de 2018.
La validación del método KIMS para determinar VAN en LCR, se basó en la
realización de las pruebas y procedimientos requeridos por el Organismo
Argentino de Acreditación (OAA) contempladas en la Guía para validación
de métodos de ensayo (GUI-LE-03) para el cambio de matriz de un método
validado en plasma/suero(11). Se estudiaron los siguientes
parámetros: linealidad, precisión, exactitud, límite de detección,
límite de cuantificación, interferencia, selectividad y especificidad (12-13).
Para estudiar los parámetros antes mencionados se utilizó un pool de
LCR libre de drogas, obtenido de muestras de pacientes remitidas al
laboratorio con solicitud de análisis citoquímico y bacteriológico, el
cual se fortificó con una solución de VAN preparada a partir de
clorhidrato de vancomicina de la marca KLONAL (VANCOMAX). Este pool fue
valorado por el método de referencia HPLC-UV y la concentración fue de
100 µg/mL. Se prepararon los estándares de VAN de distintas
concentraciones a partir del pool de LCR valorado previamente.
La determinación de VAN por KIMS se realizó en un equipo cobas C311 de
Roche, y los reactivos provistos fueron utilizados según las
especificaciones y procedimientos recomendados por el fabricante. Este
método utiliza un anticuerpo (Ac) anti-VAN que se fija de forma
covalente a micropartículas, mientras que el derivado del fármaco se
une a una macromolécula. La interacción cinética de micropartículas en
solución se induce al unirse el conjugado de la VAN al Ac que recubre
las micropartículas y se inhibe por la VAN presente en la muestra
biológica. El conjugado de VAN y la VAN presente en la muestra,
compiten por fijarse al Ac anti-VAN que recubre las micropartículas. La
interacción cinética de micropartículas resultante es indirectamente
proporcional a la cantidad de fármaco presente en la muestra (14).
El método de referencia utilizado fue la cromatografía líquida de alta
performance con detector ultravioleta (UV), en un cromatógrafo de la
marca Agilent, 1220 LC System; las condiciones cromatográficas
utilizadas fueron: columna Agilent ZORBAX Eclipse XDB-C18, 4.6x150mm, 5
µm; fase móvil isocrática compuesta por un buffer fosfato 0,025M y
Acetonitrilo (100:10 v/v) a pH 3, con un flujo de 1 mL/min; el volumen
de inyección utilizado fue 20 µL y la lectura se realizó a 205 nm.
Linealidad
La linealidad es la capacidad de un método analítico de arrojar
resultados proporcionales a la cantidad de analito presente en una
muestra, dentro de un rango determinado.
Se elaboró una curva de calibración en base a estándares de LCR de
concentración conocida de 0; 1; 2,5; 5; 7,5; 10; 15 y 20 µg/mL de VAN.
Cada estándar se midió por cuadruplicado utilizando el método KIMS. Se
realizó una recta de regresión graficando la concentración obtenida
para cada estándar por KIMS en función de la concentración preparada.
Además, se evaluó estadísticamente el procedimiento con la prueba t de
Student como un mejor indicador del modelo lineal.
Precisión
Se tomaron los datos del análisis por cuadruplicado de los distintos
estándares de LCR preparados y se calculó el desvío estándar (DE) y el
coeficiente de variación porcentual (CV%) a cada nivel de
concentración.
Límite de detección y cuantificación
Los límites de detección (LOD) y cuantificación (LOQ) se obtuvieron a
partir de la curva de linealidad; LOD= 3Sa/b; LOQ= 10Sa/b, donde Sa es
el desvío estándar de la ordenada al origen y b la pendiente.
Estudio de Interferencia
A estándares conocidos de VAN en LCR de 2,5 y 10 µg/mL se agregaron
distintos fármacos utilizados frecuentemente en pacientes internados en
terapia intensiva y, en concomitancia con VAN. Estos fármacos fueron
fluconazol (FLUCONOVAG 2 mg/mL), ceftriaxona (CEFTRIAZ 1 g) y meropenem
(KLOPENEM 500 mg) en una concentración final de 100 µg/mL. Se
analizaron los estándares de VAN con y sin agregado de interferentes
por el método KIMS con un n=10 y, para analizar los resultados, se
aplicó una prueba t para muestras apareadas.
Estudio de selectividad y especificidad
Un total de 40 muestras de LCR fortificadas con VAN, a distintas
concentraciones, se analizaron por HPLC-UV y KIMS. Para evaluar los
parámetros antes mencionados se realizó un análisis de regresión
estadístico.
Resultados
Linealidad
Del análisis de regresión se obtuvo la siguiente ecuación de la recta:
y= 0,9788 x + 0,1361; R2 = 0,9983. Del análisis estadístico se obtuvo
un tobs>tcrit (54,068>2,056) lo que permite
concluir que existe una correlación lineal estadísticamente
significativa con un nivel de confianza del 95%. El rango de medición
obtenido fue de 0 a 15 µg/mL (Figura 1).
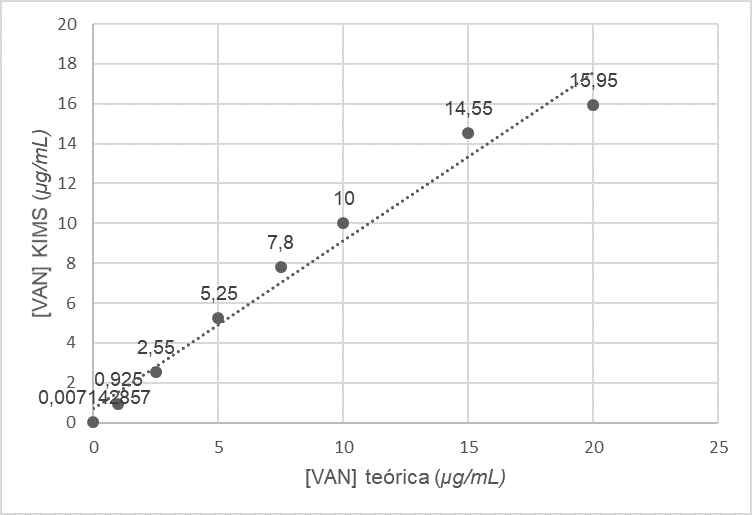
Figura N° 1. Linealidad del método KIMS para la determinación
de VAN en LCR 0-15 µg/mL. y = 0,8452x + 0,6847 R² = 0,9748
Precisión
Los resultados del estudio de precisión se expresaron en términos de
desviación estándar (DE) y coeficiente de variación porcentual (CV%) y
se muestran en la Tabla N° 1.
Tabla Nº1: Datos del análisis de precisión.
|
VAN (µg/mL)
|
X (µg/mL)
|
SD (µg/mL)
|
CV%
|
|
0
|
0,1
|
0,13
|
125,1
|
|
1
|
0,925
|
0,15
|
16,2
|
|
2,5
|
2,55
|
0,06
|
2,3
|
|
5
|
5,25
|
0,13
|
2,5
|
|
7,5
|
7,8
|
0,08
|
1,0
|
|
10
|
10
|
0,08
|
0,8
|
|
15
|
14,55
|
0,10
|
0,7
|
|
20
|
15,95
|
0,29
|
1,8
|
Límite de Detección y Cuantificación
En base a los resultados donde Sa= 0,1391 y b= 0,1361, se
pueden establecer LOD= 0,4 µg/mL (LOD= 3Sa/b) y; LOQ= 1,4 µg/mL (LOQ=
10Sa/b).
Interferencia
Los resultados obtenidos demostraron que no se observaron diferencias
estadísticamente significativas entre las muestras de estándar de VAN
con y sin el agregado de los interferentes descriptos previamente tanto
para el nivel de 2,5 como 10,0 µg/mL (p= 0,69 y 0,09 respectivamente).
Especificidad y Selectividad
Para evaluar los parámetros mencionados, se realizó una comparación de
métodos donde la variable dependiente fue KIMS y la regresora HPLC-UV
(n=40) (Tabla N° 2). Se realizó un gráfico de Bland y Altman y, en base
al mismo se detectaron muestras como posibles outliers; se realizó un
análisis de las diferencias para su detección donde el rango fue de
-3,53 a 2,08 µg/mL. En base a ello se excluyeron un total de 3 muestras
(muestra 1,4,5) por superar los límites establecidos (Figura N° 2). Se
obtuvo la siguiente ecuación de la recta por el método de cuadrados
mínimos y= 0,9151x + 1,1695; R²=0,9453 (n=37); para la cual tanto la
pendiente como la ordenada al origen se encuentran dentro de los
parámetros estadísticamente significativos (p= 1,1335-23 y 0,00025
respectivamente) (Figura N° 3).
Tabla Nº2: Comparación del método en estudio (KIMS) contra el de
referencia (HPLC-UV).
Las muestras indicadas con * son consideradas outliers.
|
N°
|
HPLC (µg/mL)
|
KIMS (µg/mL)
|
|
1*
|
16,21
|
13,2
|
|
2
|
11,53
|
11,6
|
|
3
|
10,68
|
10
|
|
4*
|
2,78
|
8,6
|
|
5*
|
4,20
|
8,3
|
|
6
|
4,71
|
6,2
|
|
7
|
3,76
|
4,6
|
|
8
|
2,88
|
3,3
|
|
9
|
2,01
|
1,7
|
|
10
|
15,28
|
13,3
|
|
11
|
9,38
|
9,4
|
|
12
|
6,92
|
7,8
|
|
13
|
6,68
|
7,2
|
|
14
|
4,57
|
5,2
|
|
15
|
3,67
|
4,2
|
|
16
|
1,91
|
2,4
|
|
17
|
5,14
|
6,7
|
|
18
|
5,12
|
5,6
|
|
19
|
3,69
|
3,9
|
|
20
|
2,57
|
2,5
|
|
21
|
3,08
|
3,8
|
|
22
|
2,67
|
2,7
|
|
23
|
9,11
|
9,7
|
|
24
|
8,37
|
9,4
|
|
25
|
6,47
|
8,9
|
|
26
|
7,72
|
9,1
|
|
27
|
6,09
|
8,9
|
|
28
|
7,73
|
8,5
|
|
29
|
7,24
|
8,6
|
|
30
|
6,90
|
8
|
|
31
|
6,94
|
7,7
|
|
32
|
6,03
|
6,9
|
|
33
|
5,56
|
6,9
|
|
34
|
4,56
|
6,3
|
|
35
|
4,71
|
5,5
|
|
36
|
2,12
|
1,8
|
|
37
|
13,96
|
14,3
|
|
38
|
13,83
|
13,9
|
|
39
|
13,78
|
13,2
|
|
40
|
12,91
|
12,6
|
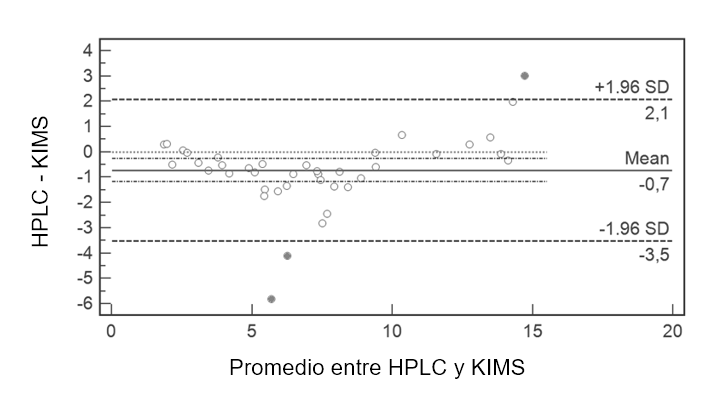
Figura N° 2. Gráfico de Bland y Altman
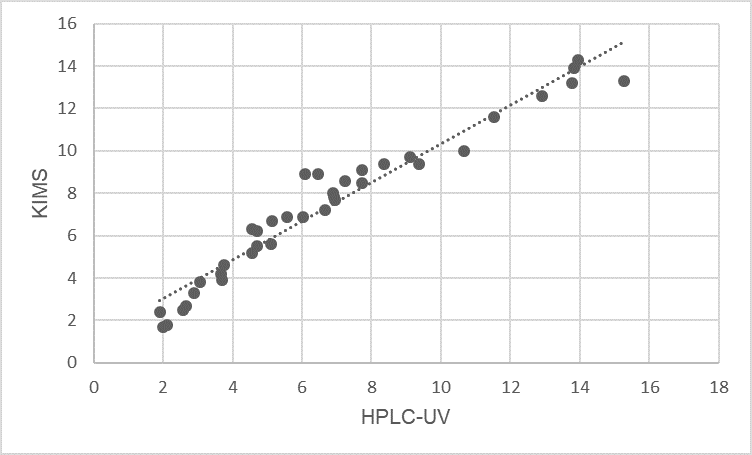
Figura N° 3. Comparación
de métodos, KIMS vs HPLC-UV. y= 0,9151x + 1,1695 R2= 0,9453
Discusión
La terapia de las infecciones del SNC con VAN puede no ser óptima, a pesar
de su amplia utilización, debido a su dificultad para atravesar la BHE. Los
factores que impactan en su penetración dentro del LCR incluyen el tamaño
molecular, lipofilicidad, unión a proteínas plasmáticas y la afinidad por
mecanismos de transporte activo(15). Su monitoreo terapéutico
permite evaluar la relación entre la eficacia clínica y sus parámetros
farmacocinéticos y, de esta forma, desarrollar un régimen terapéutico
individualizado(16). Según los resultados obtenidos, la
determinación de VAN en LCR por KIMS tiene una linealidad adecuada con un
rango de trabajo que va desde 1,4 a 15 µg/mL. El rango lineal es menor que
el establecido por el fabricante para la determinación de VAN en
suero/plasma (4,0 – 80,0 µg/mL); sin embargo, el LOQ obtenido en nuestro
trabajo es menor. Debido a la gran variabilidad interindividual reportada
para la penetración de VAN al SNC, sumada a la dependencia existente de
acuerdo con la patología subyacente y a los distintos esquemas de
administración de VAN(17-18), no se ha podido establecer un
valor de referencia para la concentración terapéutica de VAN en LCR,
unque, ciertos autores, sugieren una concentración deseada entre 5-20
µg/mL
(19) . La gran variabilidad de la concentración de VAN en LCR dada por factores
como la terapia esteroidea concomitante(20), pacientes sin
inflamación meníngea, o pacientes en estado crítico de salud; es reflejada
por la relación LCR/plasma que va de 0,00 a 0,81(21). Es por
este motivo que resulta de gran utilidad la cuantificación de valores bajos
de esta droga en la matriz ensayada.
Los ensayos de interferencia mostraron que no existe reactividad cruzada o
interferencia significativa con las drogas ensayadas, que habitualmente
pueden ser coadministradas junto con VAN(22-23). En la
comparación de métodos se observa que el método KIMS mide con un error
constante de 1,1695 µg/mL y un error proporcional de 0,9151 µg/mL respecto
del método considerado como referencia. Esto último coincide con datos
reportados en la bibliografía, en los cuales otros autores mencionan que
los métodos inmunológicos arrojan valores ligeramente superiores a los
obtenidos por HPLC(24- 25).
Conclusión
El método KIMS demostró poseer una sensibilidad y especificidad adecuadas
para la determinación de VAN en LCR, siguiendo los pasos requeridos por el
Organismo Argentino de Acreditación (OAA-05) para implementar un cambio de
matriz en el método utilizado. Se pudo demostrar que el método KIMS para la
determinación de VAN en LCR es rápido, sensible y específico.
La metodología podrá utilizarse para determinar las concentraciones de VAN
en LCR en pacientes críticos bajo tratamiento con esta droga, a fin de
lograr una mejor eficacia terapéutica y disminuir el riesgo de efectos
adversos.
Limitaciones de responsabilidad:
El presente trabajo se realizó en el Laboratorio del Hospital de Niños de
la Santísima Trinidad y no se contó con ninguna fuente de financiación
externa a la institución.
Fuentes de financiación
: Para este trabajo no se contó con fuentes de apoyo externas.
Bibliografía
1. Brunton L.; Chabner B.; Knollman B.; Goodman E Gilman. Las Bases
Farmacológicas de la Terapéutica.
11 edición, Mc Graw Hill, 2007.
2. Lenka J.; Lenka K. K.; Dagmar S.; Petr S.; Milan K. Modern methods
for vancomycin determination in biological fluids by methods based on
high-performance liquid chromatography – A review. J. Sep. Sci. 2016,
39, 6–20.
3. Muppidi K.; Pumerantz A.S.; Betageri G.; Wang J. Development and
Validation of a Rapid High-Performance Liquid Chromatography Method
with UV Detection for the Determination of Vancomycin in Mouse Plasma.
J Chromat Separation Techniq. 2013, 4:1, 165.
4. Matsumoto K.; Takesue Y.; Ohmagari N.; Mochizuki T.; Mikamo H.; Seki
M.; et al. Practice guidelines for therapeutic drug monitoring of
vancomycin: a consensus review of the Japanese Society of Chemotherapy
and the Japanese Society of Therapeutic Drug Monitoring. J Infect
Chemother. 2013, 19, 365-380.
5. Jill B. Thompson J.B.; Einhaus S.; Buckingham S.; Phelps S.J.
Vancomycin for Treating Cerebrospinal Fluid Shunt Infections in
Pediatric Patients: Review Article. J Pediatr Pharmacol Ther 2005,
10:1, 14-25.
6. Al Jeraisy M.; Phelps S.j.; Christensen M.L.; Einhaus S.
Intraventricular Vancomycin in Pediatric Patients With CSF Shunt
Infections.J.Pediatr Pharmacol Ther. 2004; 9:1, 36-42.
7. Jill B. Thompson J.B.; Einhaus S.; Buckingham S.; Phelps S.J.
Vancomycin for Treating Cerebrospinal Fluid Shunt Infections in
Pediatric Patients: Review Article. J Pediatr Pharmacol Ther 2005,
10:1, 14-25.
8. Shokouhi S.; Alavi Darazam I. Determination of vancomycin trough
level in serum and cerebrospinal fluid of patients with acute
community-acquired meningitis: A prospective study, J Infect. 2014.
9. Mark S. L.; Hatton J. Vancomycin administration into the
cerebrospinal fluid: a review. Ann Pharmacother. 1993, 27, 912-21.
10. Muppidi K.; Pumerantz A.S.; Betageri G.; Wang J. Development and
Validation of a Rapid High-Performance Liquid Chromatography Method
with UV Detection for the Determination of Vancomycin in Mouse Plasma.
J Chromat Separation Techniq. 2013, 4:1, 165.
11. MC-OAA: Manual de la Calidad del OAA: vigente
12. International Union of Pure and Applied Chemistry (IUPAC).
Harmonized Guidelines for Single-Laboratory Validation of Methods of
Analysis – IUPAC Technical Report – Pure & Appl.Chem. 2002, 74:5,
835-855.
13. International Union of Pure and Applied Chemistry (IUPAC).
Nomenclature in Evaluation of Analytical Methods including detection
and quantification capabilities- IUPAC recommendations– Pure &
Appl.Chem. 1995, 67:10, 1699-1723.
14. Roche. ONLINE TDM Vancomycin Gen.3. 2017, 1-5.
15. Beach J.E.; Perrott J.; Turgeon R.D.; Ensom M.H.H. Penetration of
Vancomycin into the Cerebrospinal Fluid: A Systematic Review. Clin
Pharmacokinet. 2017. doi.10.1007/s40262-017-0548-y
16. Men P.; Li H.B.; Zhai S.D.; Zhao R.S. Association between the
AUC0-24/MIC Ratio of Vancomycin and Its Clinical Effectiveness: A
Systematic Review and Meta-Analysis. PLoS ONE 2016, 11 (1).
17. Mader M.M.D.; Czorlich P.; König C.; Fuhrmann V.; Kluge S.;
Westphal M.; Grensemann J. Intrathecal penetration of meropenem and
vancomycin administered by continuous infusion in patients suffering
from ventriculitis - a retrospective analysis. Acta Neurochir. 2018,
160:11, 2099-2105.
18. Matsumoto K.; Takesue Y.; Ohmagari N.; Mochizuki T.; Mikamo H.;
Seki M.; et al. Practice guidelines for therapeutic drug monitoring of
vancomycin: a consensus review of the Japanese Society of Chemotherapy
and the Japanese Society of Therapeutic Drug Monitoring. J Infect
Chemother. 2013, 19, 365-380.
19. Al Jeraisy M.; Phelps S.j.; Christensen M.L.; Einhaus S.
Intraventricular Vancomycin in Pediatric Patients With CSF Shunt
Infections.J.Pediatr Pharmacol Ther. 2004; 9:1, 36-42.
20. Lee SA, Kim JK, Jo DS, Kim SJ. Response of Vancomycin according to
Steroid Dosage in Pediatric Patients with Culture-Proven Bacterial
Meningitis. Infect Chemother. 2017, 49:4, 262-267.
21. Beach J.E.; Perrott J.; Turgeon R.D.; Ensom M.H.H. Penetration of
Vancomycin into the Cerebrospinal Fluid: A Systematic Review. Clin
Pharmacokinet. 2017. doi.10.1007/s40262-017-0548-y
22. Usman M.; Hempel G. Development and validation of an HPLC method
for the determination of vancomycin in human plasma and its comparison
with an immunoassay (PETINIA). SpringerPlus. 2016, 5:124.
23. Tariq A.; Siddiqui M.R.; Kumar J.; Reddy D.; Singh Negi P.;
Chaudhary M.; et al. Development and validation of high performance
liquid chromatographic method for the simultaneous determination of
ceftriaxone and vancomycin inpharmaceutical formulations and biological
simples. ScienceAsia. 2010, 36, 297–304.
24. Barco S.; Castagnola E.; Gennai I.; Barbagallo L.; Loy A.; Tripodi
G.; Cangemi G. Ultra high performance liquid chromatography tandem mass
spectrometry vs. commercial immunoassay for determination of vancomycin
plasma concentration in children. Possible implications for everyday
clinical practice, Journal of Chemotherapy. 2016, 28:5, 395-402.
25. Shokouhi S.; Alavi Darazam I. Determination of vancomycin trough
level in serum and cerebrospinal fluid of patients with acute
community-acquired meningitis: A prospective study, J Infect.
2014.