10.31047/1668.298x.v41.n1.40982
Artículos
Aportes a la morfología de semillas de Hibiscus cannabinus L. y ajuste de la prueba de tetrazolio para estimar viabilidad y vigor
Contributions to the morphology of Hibiscus cannabinus L. seeds and ad-justment of the tetrazolium test to estimate viability and vigor.
A d V Bornand 1
C G Agüero 1
M L Molinelli 1
1 Bornand, A. d. V (ORCID: 0000-0001-8735-3359): Universidad Nacional de Córdoba, Facultad de Ciencias Agropecuarias, Departamento de Fundamentación Biológica, Cátedra Botánica Morfológica. Córdoba, Argentina. Agüero, C. G. (ORCID: 0000-0001-7319-4844): Universidad Nacional de Córdoba, Facultad de Ciencias Agropecuarias, Departamento de Producción Vegetal, Laboratorio de Análisis de Calidad de Semillas (LASIDYS). Córdoba. Argentina. Molinelli, M. L. (ORCID: 0000-0003-0689-9267): Universidad Nacional de Córdoba, Facultad de Ciencias Agropecuarias, Departamento de Fundamentación Biológica, Cátedra Botánica Morfológica. Córdoba, Argentina. Correspondencia a: alejandrabornand@agro.unc.edu.ar
RESUMEN
Hibiscus cannabinus L. es una especie anual cultivada por sus fibras. Se profundizó la descripción morfológica de las semillas de los cultivares 'Endora' y 'Tainung 1', se adecuó y ajustó un procedimiento de prueba de tetrazolio y se clasificaron los embriones según su viabilidad y vigor. En la coloración y ornamentación de las semillas participan células de las capas del episperma. Se identificaron la tapa de imbibición y el istmo y se analizó su función. Se reconocieron lípidos y proteínas en el mesofilo de los cotiledones y la ausencia de aréolas en la epidermis. Mediante la prueba de tetrazolio se establecieron patrones de tinción para clasificar las semillas según su viabilidad. Ambos cultivares presentaron valores de viabilidad aceptables. La prueba de germinación respaldó la metodología propuesta para tetrazolio. Se realizan aportes novedosos sobre la morfología de las semillas y se proponen relaciones estructura-función para el ingreso de agua. Las semillas de ambos cultivares comparten características morfológicas fundamentales para establecer los criterios de evaluación en la prueba bioquímica de tetrazolio. La adaptación del protocolo de la prueba de viabilidad por tetrazolio permitió la clasificación de las semillas como viables en tres categorías (vigor alto, medio y bajo) y no viables.
Palabras clave: calidad, germinación, kenaf, Malvaceae, morfología de semilla.
ABSTRACT
Hibiscus cannabinus L. is an annual species cultivated for its fibers. The morphological description of the seeds of the cultivars 'Endora' and 'Tainung 1' was broadened, a tetrazolium test procedure was adapted and adjusted, and the embryos were classified according to their viability and vigor. Cells from the seed coat layers participate in the seed coloration and ornamentation. The imbibition cap and the isthmus were identified, and their function was analyzed. Lipids and proteins were recognized in the mesophyll of cotyledons and the absence of areoles in the epidermis. Using the tetrazolium test, staining patterns were established to classify the seeds according to their viability. Both cultivars presented acceptable viability values. The germination test supported the proposed methodology for tetrazolium. Novel contributions are made to seed morphology, and structure-function relationships for water intake are proposed. The seeds of both cultivars share the morphological characteristics that are fundamental to the establishment of evaluation criteria in the tetrazolium biochemical test. The adapted tetrazolium viability test protocol allowed the seeds classification as either viable into three categories (high, medium, and low vigor) and non-viable seeds.
Keywords: germination, kenaf, Malvaceae, quality, seed morphology.
INTRODUCCION
Hibiscus cannabinus L. Malvaceae, conocida como “kenaf”, es una especie anual originaria de África, tradicionalmente cultivada por las propiedades mecánicas de las fibras de sus tallos, y actualmente utilizada como biocombustible en el desarrollo de productos tecnológicos renovables para la industria textil y automotriz (Müssig, 2010; Monti y Alexopoulou, 2013). Los principales productores son China, India y Tailandia, y si bien en Argentina no está registrado su cultivo, según datos del Censo Nacional Agropecuario realizado en el año 2018 (INDEC, 2021), existen antecedentes en los cultivares ‘Endora' y ‘Tainung 1' que contemplan los aspectos agroecológicos para su adaptación en el país (Acreche et al., 2005; Pascualides et al., 2013; Falasca et al., 2014). Por otro lado, en relación con la morfología de las semillas de las Malvaceae, Boesewinkel y Bouman (1984) describieron características anatómicas generales y también se realizaron descripciones anatómicas en Gossypium spp. “algodón” y en Abutilon theophrasti por Hayward (1953), Winter (1960), Moreira de Carvalho y Nakagawa (1988), y estudios taxonómicos de las Malvaceae por Abid et al. (2016). Además, los aspectos relacionados a la dormición de esta familia fueron mencionados por Baskin y Baskin (2014). Entre los antecedentes del género Hibiscus, se destaca el estudio monográfico de H. esculentus (Abelmoschus esculentus (L.) Mey) realizado por Olteanu (1933), en el que se detalla la anatomía de la semilla; mientras que Martin (1946), describió y clasificó trece especies de Hibiscus según las características del embrión y endosperma, tales como la forma, el tamaño y la posición relativa. En relación a H. cannabinus, Corner (2009) presentó la descripción del episperma de esta especie junto con las características seminales de otras Malvaceae.
En cuanto a los métodos para el análisis de calidad de semillas, en las Reglas Internacionales para Análisis de Semillas (ISTA) se menciona la metodología en laboratorio del ensayo de germinación de H. cannabinus, pero no se incluye la metodología correspondiente al análisis de tetrazolio (TZ). Tampoco se encuentra en las Hojas de Trabajo de la Prueba de Tetrazolio (ISTA, 2003). A nivel de género, Hibiscus está citado en el Manual de la Prueba de Tetrazolio de ISTA (Moore, 1985), con cuatro metodologías a seguir sin mencionar las especies evaluadas; idénticas metodologías se proponen en las Reglas para Análisis de Semillas (Ministerio de Agricultura, Ganadería y Abastecimiento de Brasil, 2009). Por otro lado, metodologías diferentes para esta prueba se describen en las Hojas de Trabajo de la Prueba de Tetrazolio (ISTA, 2003), para cuatro géneros de Malvaceae: Abutilón, Gossypium, Hibiscus y Malva, mientras que, en Association of Official Seed Analysts (AOSA, 2010), se presenta un método de análisis para aplicar tanto en Altea, como en Gossypium, Hibiscus, Malva y Sphaeralcea. Además, McCarty y Baskin (1978) desarrollaron una prueba de tetrazolio para Gossipyum hirsutum L.
Al comparar las pruebas de germinación y tetrazolio, esta última presenta ventajas sobre el ensayo de germinación, ya que permite obtener resultados en menor tiempo y establecer las causas de la pérdida de viabilidad (Delouche et al., 1962; Moore, 1962). En este sentido, Franga Neto et al. (1988) realizaron estudios en Glycine max (L.) Merr. “soja” y determinaron que la diferencia entre los resultados de ambas pruebas no debe exceder el 5 % para garantizar la eficacia de la prueba de tetrazolio.
En un trabajo reciente, Bornand y Beltramini (2021) caracterizaron la semilla de H. cannabinus y estudiaron la influencia del almacenamiento sobre la viabilidad de los cultivares ‘Endora' y ‘Tainung 1'. Sin embargo, se desconocen particularidades morfológicas que merecen especial atención sobre las características del episperma y la presencia de zonas predeterminadas para el ingreso del agua, la naturaleza de las sustancias de reserva y la existencia de áreas especializadas en el embrión para la transferencia de nutrientes.
En base a lo expuesto, se estudiaron comparativamente y desde la perspectiva de la tecnología de semillas los cultivares ‘Endora' y ‘Tainung 1' de H. cannabinus, con los objetivos de profundizar la descripción morfológica de las semillas, adecuar y ajustar un procedimiento de prueba de tetrazolio y clasificar los embriones según su viabilidad y vigor.
MATERIALES Y MÉTODOS
Material estudiado
Los estudios se realizaron en semillas de los cultivares ‘Endora' y ‘Tainung 1' de Hibiscus cannabinus L., cosechadas en mayo de 2015, de parcelas ubicadas en un predio al noroeste de la ciudad de Córdoba, Argentina (31° 24' 08.1 ”S y 64° 15' O). Los frutos se cosecharon y trillaron en forma manual, y las semillas limpias de impurezas fueron almacenadas en bolsas de papel kraft a temperatura ambiente (20 ± 3 °C) durante treinta meses. El porcentaje de humedad al momento de realizar los ensayos fue para ‘Endora' 9,4 ± 0,05 y para ‘Tainung 1' de 9,5 ± 0,05; se determinó el peso de mil semillas en cada cultivar, con ocho repeticiones de cien semillas (ISTA, 2021).
Descripción morfológica de la semillaPara determinar el color de la superficie seminal se empleó el código de colores establecido en 1927 por el Instituto Alemán de Garantía de Calidad y Etiquetado: ReichsausschuB für Lieferbedingungen und Gütesicherung (RAL, por sus siglas en alemán), de la carta de colores RAL Classic (RAL, 2024), mediante un microscopio estereoscópico marca Zeiss modelo Stemi DV4. Se utilizó también este instrumento para observar semillas enteras y cortadas en los planos transversal y sagital y para describir el indumento, el patrón de ornamentación, la forma de la semilla y el episperma en vista superficial. Estas características se analizaron según los criterios y la terminología propuestos por Werker (1997), Endo y Ohashi (1998), Font Quer (2001), Kirkbride, Gunn y Weitzman (2003), Evert (2008) y Corner (2009). Se identificaron zonas predeterminadas de ingreso del agua en el episperma, mediante la observación bajo microscopio estereoscópico de semillas, previamente sumergidas en agua durante 48 h. La descripción del endosperma y embrión, se realizó según Martin (1946). Se analizaron las variables, ancho del episperma, endosperma y embrión. Para determinar el ancho del episperma y endosperma, se realizaron preparados temporarios de cortes transversales de la parte media a nivel de la rafe, en quince semillas de cada cultivar, las mediciones se tomaron con micrómetro ocular de microscopio óptico marca Nikon modelo Eclipse E 400 y los valores se expresaron en micrones. Mientras que, para determinar el ancho del embrión, se realizaron cortes transversales en la zona media a nivel de la rafe en quince semillas de cada cultivar y las mediciones se tomaron con un calibre digital Marca Bahco, expresadas en milímetros. Las medidas del ancho del episperma, endosperma y embrión se compararon entre cultivares.
Para la descripción anatómica se aplicaron las metodologías clásicas de la histología vegetal mediante la elaboración de preparados temporarios para microscopía óptica, con las técnicas descriptas por Zarlavsky (2014). Para ablandar los tejidos de las semillas, estas se colocaron entre papel humedecido con agua destilada por 8 h; se realizaron cortes a mano libre con hoja de afeitar en la zona media de la semilla y a nivel de la rafe en el plano transversal; como medio de montaje se utilizó una solución acuosa de glicerina 50 % v/v. Para la coloración de los tejidos, las secciones se tiñeron con safranina (1 g de safranina disuelta en 100 mL de solución hidroetanólica 50 % v/v) y solución acuosa de azul astral (0,5 g de azul astral disuelto en 100 mL de agua). La caracterización se complementó con pruebas histoquímicas para determinar la naturaleza de las sustancias de reserva: reactivo de Lugol para almidón, solución saturada de eosina para proteínas, Sudán IV a saturación en alcohol etílico 70 ° para lípidos y sulfato férrico en formol 10 °% p/v para taninos. Se describieron los tejidos del episperma y se interpretó la influencia de las capas más externas en el diseño de la ornamentación y el color de la superficie seminal. En el estudio de los tricomas se describieron las características citológicas y su disposición, se midieron las variables número de tricomas por grupo y el largo de los mismos, tomados de dos grupos de tricomas en diez semillas de cada cultivar analizado. Para la longitud de los tricomas, se tomó el de mayor longitud y el de menor longitud de cada grupo y se calculó el promedio entre ambos valores. Para estas determinaciones se utilizó un microscopio óptico marca Nikon modelo Eclipse E 400 con micrómetro ocular para el registro de las mediciones. El número de tricomas por grupo y el largo se comparó entre cultivares. Se detallaron las variaciones del episperma en la zona de la cálaza y se establecieron relaciones con sus funciones en relación a la entrada de agua. Se analizaron las características citológicas del endosperma y embrión. Para reconocer aréolas, se siguió la metodología propuesta por Perissé y Tourn (2015), se sumergieron las semillas en solución al 1 % de cloruro de 2, 3, 5 trifenil tetrazolio (TZ) durante 24 h a temperatura ambiente, se retiró el episperma y se observaron bajo microscopio estereoscópico. Se tomaron registros fotográficos como complemento de los ensayos.
Ajuste de la prueba de tetrazolioEl diseño de la prueba de tetrazolio de H. cannabinus se basó en los protocolos de viabilidad de McCarty y Baskin (1978) realizados en G. hirsutum, en el Manual de la Prueba de Tetrazolio para lo establecido en el género Hibiscus (Moore, 1985), en las Hojas de Trabajo de la Prueba de Tetrazolio (ISTA, 2003) y en el Manual de Prueba de Tetrazolio de AOSA (2010). Además, se consultaron las Normas de análisis de semillas del Ministerio de Agricultura, Pecuaria y Abastecimiento de Brasil (2009), en las que se cita la metodología de Moore (1985) con mención a Hibiscus spp. A partir de estas metodologías, se elaboró un protocolo particular para este caso de estudio.
Implementación de la prueba de tetrazolio y clasificación de los embriones según su viabilidad
La metodología propuesta para la prueba de tetrazolio cuyo fin es evaluar viabilidad, se aplicó en las semillas de los cultivares ‘Endora’ y ‘Tainung 1’. Para estimar la viabilidad se observaron los embriones en vista externa: cotiledones y el eje radícula-hipocótilo (Figura 1) y se categorizaron las semillas en viables y no viables según la localización, extensión y naturaleza del tejido teñido.
Evaluación de la prueba de tetrazolioComo parámetro de referencia del test de TZ, se realizaron ensayos de germinación estándar, en los que se colocaron cien semillas, entre papel marca Valot Supreme humedecido 2,5 veces su peso con agua destilada. Los rollos se ubicaron en bandejas de plástico y estas se envolvieron en bolsas de polietileno para mantener la humedad. Se acondicionaron en cámara de germinación con temperatura alternante de 20-30 °C, con un fotoperiodo de 8 h de luz y 16 h de oscuridad de acuerdo a normas internacionales (ISTA, 2021). Al octavo día, se determinó el porcentaje de plántulas normales, plántulas anormales, semillas duras, semillas frescas y semillas muertas (ISTA, 2018). La determinación se realizó por cuadriplicado para cada cultivar. Los resultados se compararon con los obtenidos de la prueba ajustada de tetrazolio y se determinó la eficacia según Franga Neto et al. (1988).
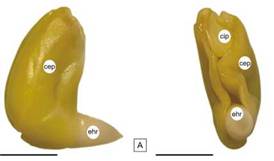
Figura 1: Embrión de H. cannabinus. A: vista lateral; B: vista inferior. Abreviaturas: cep: cotiledón externo plegado, cip: cotiledón interno plegado, ehr: eje radícula-hipocótilo. Escala= A y B: 3 mm.
Clasificación de las semillas según su vigorLas semillas viables se clasificaron según la intensidad de la coloración, la extensión del área embrional teñida y la localización de los tejidos necróticos con tres niveles de vigor (vigor alto, medio y bajo), siguiendo los lineamientos de McCarty y Baskin (1978) en Gossyplum hirsutum y por ISTA (2021) en Glycine max.
Diseño experimental y análisis estadísticoLas caracterizaciones realizadas en las semillas, los porcentajes de viabilidad, vigor y germinación se sometieron a un Análisis de la Varianza (ANAVA) y se determinaron las diferencias mínimas significativas entre las medias (DMS) de los tratamientos, con la prueba de Di Rienzo, Guzmán y Casanoves (DGC) a un nivel de significancia de 0,05 a través del programa Infostat (Di Rienzo et al., 2021). Se evaluó la eficiencia en la determinación de la viabilidad entre los dos ensayos realizados en los dos cultivares de H. cannabinus, mediante el Coeficiente de Correlación de Pearson.
RESULTADOS Y DISCUSIÓN
Descripción morfológica de la semilla
Las semillas de los cultivares ‘Endora' y ‘Tainung 1' se observaron a simple vista de color gris amarronado (RAL 7013) con indumento puberulento (Figura 2 A). El análisis en detalle (Figura 2 B-I), reveló la presencia de tres colores: amarillo oro (RAL 1004), blanco grisáceo (RAL 9002) y marrón tierra (RAL 8028); un patrón de ornamentación regular caracterizado por surcos levemente insinuados tipo foveolado, con distribución longitudinal concéntrica y grupos de tricomas dispersos (Figura 2 B, C). En algunas semillas los surcos fueron más evidentes o estaban interrumpidos por máculas marrones de apariencia lisa (Figura 2 D, E). Además, se observaron semillas con máculas extendidas y grupos de tricomas contorneados por vestigios del patrón foveolado (Figura 2 F-I). El color de referencia de las semillas observado a simple vista, gris amarronado, coincide con el informado por Bornand y Beltramini (2021); sin embargo, en el presente trabajo la descripción detallada de la superficie seminal reveló una combinación de colores, proveniente de la pigmentación de los diferentes estratos celulares y relacionada con un patrón de ornamentación foveolado, según la clasificación de la escultura de la superficie seminal de Werker (1997).

Figura 2: Semillas de H. cannabinus. A: semillas a simple vista con gradación del color del episperma en la gama del gris amarronado; B, D, F, H: semillas observadas con microscopio estereoscópico, ordenadas según el episperma decreciente en color gris y creciente en marrón. C, E, G, I: detalles del indumento observados con microscopio estereoscópico. Escala= A: 2,5 mm; B, D, F y H: 2 mm; C, E, G e I: 1 mm.
Las semillas se caracterizaron por su forma en vista lateral, triangular con una depresión central y en vista ventral, cuneiforme; se observó el extremo del lóbulo radicular aguzado, el micrópilo de forma puntual e inmediatamente por encima, el hilo triangular de color blanco (Figura 3 A-B).
Werker (1997) explicó que la forma de la semilla se puede atribuir al embrión, como se observó en este caso en el que la curvatura del embrión determina la forma triangular de las mismas.
Al observar el episperma en vista superficial, se comprobó que el funículo es persistente, adnato a la rafe, linear y con el extremo distal obovado, formando una “tapa” que cubre la zona calazal con abundante indumento comoso; en el margen superior del funículo se insinúa una línea de separación del episperma (Figura 3 B-C). Al extraer la tapa de la zona calazal, se evidenció una hendidura elíptica, con una línea recta central, mientras que, al realizar el mismo procedimiento en las semillas sumergidas en agua, se distinguió una apertura delimitada por los márgenes internos de dicha hendidura (Figura 3 D). Boesewinkel y Bouman (1984) describieron a la “tapa de imbibición” como una válvula ubicada en la región calazal de algunas semillas de Malvaceae, que se puede desprender y originar una apertura permitiendo la entrada del agua, esta descripción coincide con la tapa identificada en H. cannabinus.
Al retirar el epispema, se observó una membrana que rodea al endosperma, dicha cubierta posee una pigmentación leve que se intensifica notoriamente en la zona calazal (Figura 3 E). Las sustancias de reserva se distribuyen como una capa delgada de endosperma alrededor del embrión y entre los pliegues de los cotiledones, sin embargo, en la cara ventral de la semilla adquiere mayor espesor (Figura 3 F).
El embrión se caracterizó por ocupar la totalidad de la semilla, la curvatura en sentido longitudinal ventral determina la cara dorsal convexa de la semilla y la posición de los cotiledones es oblicua en relación con el eje embrional; se observaron los cotiledones foliosos amplios y el externo se encontró plegado sobre el interno en sentido longitudinal radial (Figura 3 F). El cotiledón externo presentó el margen posterior basal dividido en dos lóbulos que se tocan por sus extremos sobre la radícula (Figura 3 G).
Las características observadas en cuanto a la escasa presencia de endosperma y los cotiledones foliosos coinciden con las descriptas para Gossypium spp. por Hayward (1953). Además, en estudios realizados en semillas de esta última especie, Moreira de Carvalho y Nakagawa (1988) explicaron que los cotiledones son foliosos, delgados y están enrollados en torno del embrión; a pesar de consumirse el endosperma durante el proceso de embriogénesis, estos no se vuelven voluminosos.
Se destacó el eje radícula-hipocótilo con la gémula no desarrollada y la prominencia de la radícula expuesta con el extremo triangular (Figura 3 F, H, I). La gémula no desarrollada es mencionada en la terminología propuesta por Kirkbride et al. (2003) como rudimentaria; además estos autores indicaron que la mayoría de las semillas que poseen gémula rudimentaria, tienen la radícula bien desarrollada, en coincidencia con lo observado en H. cannabinus. Según esta caracterización del embrión, la semilla coincide con la clasificación realizada por Martin (1946) para Hibiscus incanus Wendl: dentro de la división axial, subdivisión foliada con embrión plegado.
En relación con las variables analizadas, el ancho de episperma y endosperma presentó valores semejantes en los dos cultivares, mientras que se registraron diferencias significativas en el peso promedio de 1000 semillas y el ancho del embrión, siendo ‘Endora' el que presentó los mayores valores (Tabla 1). Estas variables morfológicas se pueden relacionar con un mayor desarrollo de la lámina de los cotiledones foliosos y su función reservante; de este modo, el mayor peso de las semillas obtenido en ‘Endora' se asocia con los valores mayores que registró en el ancho del embrión, ambos atribuibles a los cotiledones.
En relación a la descripción anatómica del episperma, las características citológicas de los tejidos fueron semejantes en las semillas de ambos cultivares (Figura 4 A). El estrato externo posee aspecto tenue y está constituido por células aplanadas, de contorno penta a hexagonal, con paredes delgadas, las anticlinales rectas y la periclinal externa levemente cóncava. También se observaron células cortas con paredes engrosadas y lignificadas con lóbulos que divergen desde el centro y le confieren el aspecto de estrellas, “astroesclereidas”, solitarias o en grupos alineados que forman hileras longitudinales discontinuas (Figura 4 B y C).
Barthlott (1981) explicó que las características de las células de la capa más externa del episperma (forma, contorno de paredes anticlinales y curvatura de la pared periclinal) y la combinación de tipos celulares diferentes, como la presencia de idioblastos, determinan la ornamentación de la superficie seminal. Font Quer (2001) definió a los idioblastos como células que, por su forma, tamaño o función difieren de las restantes células del mismo tejido y aclara que se pueden presentar aislados o reunidos. En este trabajo se confirma que, tanto las células aplanadas del estrato tenue como los idioblastos astroesclereidas, participan en el diseño de la ornamentación foveolada del episperma de H. cannabinus.
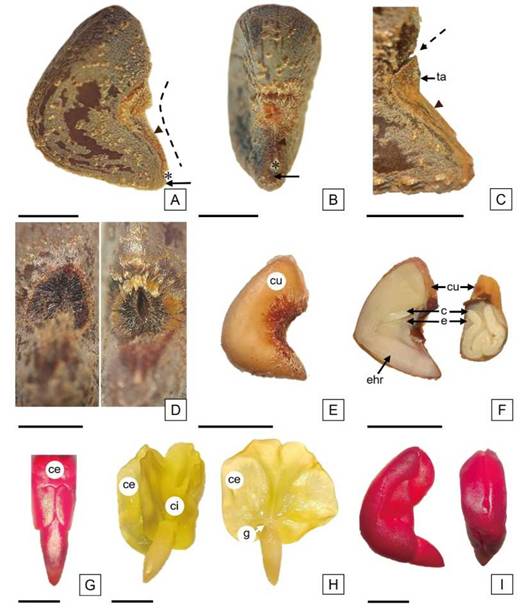
Figura 3: Morfología general de la semilla de H. cannabinus. A: Vista lateral de la semilla. B: Vista ventral de la semilla. C: Detalle de la rafe y el funículo fusionado al episperma, se indica la separación incipiente entre ambos en el borde superior de la tapa (se extrajeron los tricomas). D: Vista ventral con detalle de la zona calazal, fotomicrografía izquierda con hendidura intacta en semilla sin embeber (se extrajeron los tricomas y la tapa); fotomicrografía derecha con apertura de la hendidura en semilla embebida (se extrajo la tapa). E: vista lateral de la semilla, se destaca la cubierta con proliferación de células pigmentadas en la zona calazal. F: Semillas en corte sagital (a la izquierda), se observa la cara dorsal convexa y el embrión curvo en sentido longitudinal ventral, y en corte transversal (a la derecha), con los cotiledones plegados en sentido longitudinal radial. G: Vista dorsal del embrión teñido con TZ para visibilizar en el cotiledón externo, el margen basal dividido en dos lóbulos, se observa la radícula triangular. H: Embriones: en el de la izquierda, los cotiledones se desplegaron parcialmente; en el de la derecha, los cotiledones se desplegaron en su totalidad y se extrajo el cotiledón interno, se observa la gémula rudimentaria y el eje radícula-hipocótilo bien desarrollado. I: Embriones teñidos con TZ, con coloración uniforme, sin aréolas (vista lateral y dorsal). Referencias: cabeza de flecha indica funículo; línea punteada indica la rafe; asterisco indica hilo; flecha indica micrópilo; flecha punteada señala el inicio de la zona de fractura entre el funículo y el episperma. Abreviaturas= e, endosperma; ehr: eje radícula-hipocótilo; cu: cubierta; ci: cotiledón interno; ce: cotiledón externo, g: gémula rudimentaria; ta: tapa calazal. Escala= A, B, C, E y F: 2,5 mm; D: 1 mm y G, H e I: 2 mm.

Tabla 1: Valores promedio y error estándar del peso de 1000 semillas, ancho del episperma, endosperma y embrión de cultivares de H. cannabinus. Letras iguales obtenidas por el test DGC, indican que no hay diferencias estadísticamente significativas entre las medias involucradas (p>0,05)
Por otro lado, al analizar la influencia de las capas más externas del episperma en el diseño de la ornamentación de la superficie seminal, se observó que la alternancia entre el estrato tenue y las hileras de astroesclereidas, produce un patrón foveolado con surcos apenas insinuados característico en las semillas con predominio del color blanco grisáceo. Mientras que en las semillas que presentaron surcos más pronunciados y acentuados por el colapso y posterior desprendimiento de las paredes periclinales externas de las células del estrato tenue, las astroesclereidas permanecieron intactas debido a sus paredes gruesas. De este modo, se evidencian hileras blanco grisáceas alternando con hileras de color marrón tierra debido a la exposición de capas celulares más internas.
En algunas semillas se observó el patrón de ornamentación foveolado modificado tanto por el desprendimiento del estrato tenue como el de las hileras de astroesclereidas, con lo cual aumentan progresivamente las áreas que exponen los estratos celulares más internos. Como consecuencia de este proceso, se desarrollan máculas de superficie lisa (debido a la exposición del extremo distal plano de las macroesclereidas) y de color marrón tierra por la presencia de células taníferas. Werker (1997) aclaró que si bien las células de la capa externa de la cubierta seminal, principalmente las paredes periclinales externas, son las principales responsables de la ornamentación de la superficie, también las características estructurales de las células de los estratos internos pueden contribuir a la ornamentación cuando la capa externa se desprende, tal como sucede en las semillas de la especie analizada.
En relación al estudio de los tricomas, se destacó la presencia de grupos de tricomas dispuestos en hileras (tricomas en placa), aplicados, eglandulares y bicelulares, con la célula basal de paredes gruesas y la apical con el extremo agudo y corpúsculos en su interior que no se disolvieron con ácido clorhídrico (Figura 4 D, E). Los tricomas en placa ya fueron mencionados para H. cannabinus por Corner (2009), sin embargo, en este trabajo se detallan sus particularidades citológicas y la disposición concéntrica en el episperma, que concuerda con la mencionada para Hibiscus aristivalvis por Abid et al. (2016).
En las semillas que presentaron el patrón de ornamentación foveolado modificado, los tricomas en placa de color amarillo oro (idioblastos), se mantienen rodeados de vestigios del estrato tenue blanco grisáceo.
Las variables longitud de tricomas y número de tricomas por placa registraron diferencias (p<0,05), siendo ‘Endora' el que obtuvo las mayores longitudes (165,06 |um ± 5,28) en relación a ‘Tainung 1' (147,20 |um ± 5,28); mientras que en el número de tricomas por placa, ‘Tainung 1' presentó valores mayores (14,55 ± 0,48) en comparación con ‘Endora' (11,65 ± 0,48). Sin embargo, estas diferencias no se manifestaron en el aspecto puberulento característico del indumento de las semillas de ambos cultivares. Werker (1997) señaló que si bien los tricomas son poco comunes en el episperma de las semillas, constituyen un carácter diagnóstico, ya que son rasgos propios de algunas familias, como es el caso de las Malvaceae; en su trabajo se ilustran los tricomas en placa de H. cannabinus, aunque carecen de una descripción citológica.
A continuación del estrato externo del episperma, se destaca una capa de células alargadas radialmente y con faceta hexagonal, de paredes muy gruesas y lignificadas, con el lumen ocluido en los extremos y reducido en la parte media; estas células columnares (macroesclereidas) están dispuestas en empalizada y presentan una línea horizontal continua y cercana al borde tangencial externo de la capa, denominada línea de luz (Werker, 1997) (Figura 4 A, F). Las características citológicas de las macroesclereidas coinciden con las células de Malpighi descriptas por Corner (2009) para H. cannabinus y según Evert (2008) están altamente especializadas, con funciones mecánicas de protección e impermeabilización al agua. Inmediatamente del extremo proximal de las macroesclereidas, se ubica una hilera de células con la base redondeada y cortamente prolongadas, de paredes gruesas y contenidos pigmentados en su interior; en la prueba histoquímica se tiñeron de color pardo negruzco, indicando la presencia de taninos (Figura 4 F).
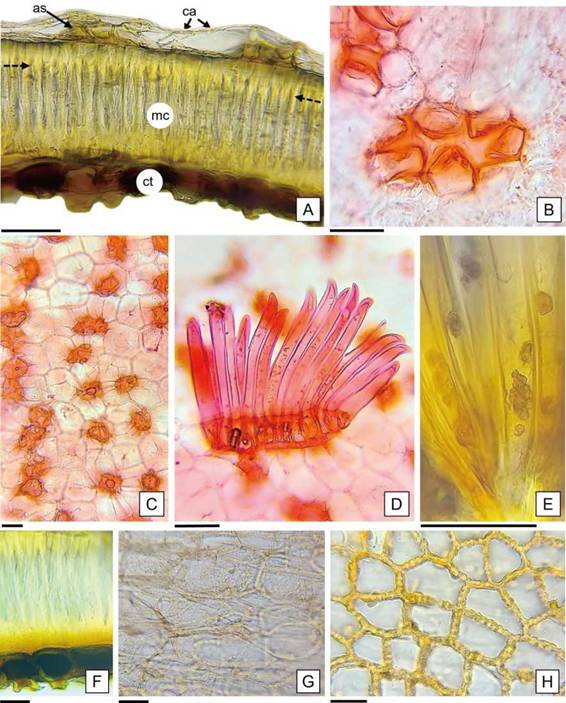
Figura 4: Anatomía del episperma de H. cannabinus. A: Corte transversal del episperma. B: Detalle de la astroesclereida en vista superior rodeada de células de paredes delgadas. C: Vista superior del episperma con astroesclereidas dispuestas en hileras, se observa el contorno hexagonal de las macroesclereidas (por transparencia). D: Tricomas dispuestos en placa con las células basales de paredes engrosadas. E: Detalle de corpúsculos en el interior de los tricomas. F: Macroesclereidas y células con taninos. G, H: Cubierta que limita con el endosperma en vista superficial: células parenquimáticas con paredes delgadas y células con paredes moniliformes, respectivamente. Abreviaturas = flecha punteada: línea de luz de las macroesclereidas; as: astroesclereidas; ca: células aplanadas; ct: célula con taninos; mc: macroesclereidas. Escalas= A-F: 50 pm. G-H: 15 pm.
En la cubierta previa al endosperma, se observaron tres capas superpuestas: una formada por células parenquimáticas aplanadas y alargadas en sentido tangencial con paredes delgadas e incoloras; otra intermedia, formada por células con las paredes radiales irregularmente engrosadas de aspecto moniliforme; y la más interna consistente en una capa blanca, compacta e indiferenciada (Figura 4 G, H; 6 A). Werker (1997) mencionó que en las semillas de Gossypium, la capa de células de paredes moniliformes se desprende a nivel de la pared tangencial externa y forma junto con los remanentes de la nucela (descripta en el presente trabajo como una capa blanca indiferenciada) y los restos del endosperma, una membrana interna que podría cumplir un rol de protección. Además, Hayward (1953) describió esta capa de células de paredes moniliformes en Gossypium, y la nombró como células en festón, por su aspecto ondulado. Mientras que Werker (1997), la mencionó como fringe layery las describió en las Malvaceae como una capa de células con protuberancias en sus paredes. Esta autora, explicó como posible función de esta capa, su participación en el transporte de nutrientes hacia el interior del saco embrionario durante los procesos de endospermogénesis y embriogénesis, actuando como células de transferencia, además de su rol mecánico como protección del embrión. Serían necesarios estudios ontogénicos para dilucidar dichos aspectos.
En la zona de la cálaza, el episperma presenta variaciones en relación a las características descriptas, se observa el estrato externo con abundantes tricomas comosos y hacia el interior se desarrollan columnas de células suberosas organizadas radialmente que delimitan cámaras de aire (Figura 5 A, B). En relación con la capa de macroesclereidas, se encuentra interrumpida y en la capa inferior las células taníferas desarrollan “brazos” que delimitan abundantes espacios intercelulares, constituyendo un aerénquima de 15-20 hileras en la zona media de la cálaza que se adelgaza hacia los bordes (Figura 5 C, D). Esta descripción, coincide con la zona nombrada como “istmo” en H. esculentus por Olteanu (1933) y con la presencia de “una región con forma de abertura” en Abutilón theophrasti descripta por Winter (1960). Este último autor aclaró en relación al istmo, que, si bien las macroescleridas constituyen un impedimento para la entrada de agua, la presencia de dicha región permite su ingreso. La apertura producida en la hendidura elíptica, “istmo”, de las semillas de H. cannabinus sumergidas en agua, evidenció la relación de esta zona con el ingreso del agua explicada por Winter (1960). La descripción de las características diferenciales que adquiere el episperma en la zona de la cálaza agrega información en relación con las características anatómicas de la tapa de imbibición y el istmo, que actúan en conjunto como una válvula que regula la entrada de agua en las semillas de H. cannabinus. La cubierta que rodea al endosperma también se encuentra modificada en la zona de la cálaza con proliferación de células pigmentadas que se desarrollan en hileras radiales en vista rafeal (Figura 3 E), poseen paredes delgadas y en algunas se observaron gránulos de almidón y glóbulos de lípidos (Figura 5 E-G). En la capa de células moniliformes, se identificaron estomas sólo en el área calazal (Figura 5 H). Por último, se presenta un estrato de células de forma irregular, sin espacios intercelulares, con un grosor de 10-15 hileras desordenadas, que disminuye gradualmente hacia los extremos por el colapso de las células hasta adquirir el aspecto de la capa compacta blanca del resto de la cubierta que limita con el endosperma (Figura 5 I; 6 A). Corner (2009) describió la organización del episperma de H. cannabinus con las siguientes capas celulares: exotesta, endotesta, exotegmen e hipodermis con características citológicas semejantes a los estratos celulares descriptos en este trabajo; sin embargo sería necesario un estudio ontogenético para confirmar el origen de los mismos.
El endosperma está constituido por células de formas variadas: isodiamétricas, cuadrangulares o alargadas; dispuestas en hileras desordenadas de hasta veinte células (Figura 6 A). Como resultado de las pruebas histoquímicas realizadas, se detectaron lípidos y proteínas como sustancias de reservas (Figura 6 B y C); en coincidencia con las identificadas en los cotiledones de las semillas de Gossypium sp. por Moreira de Carvalho y Nakagawa (1988).
Con respecto a las características citológicas analizadas en el embrión de ambos cultivares, se observaron rasgos semejantes en los cotiledones externo e interno. Las células epidérmicas de ambos cotiledones, tanto en la cara abaxial como adaxial, son isodiamétricas a levemente rectangulares (en transcorte), con la pared tangencial externa recta y engrosada y contenido citoplasmático denso (Figura 7 A y B). Si bien estas características son semejantes a las descriptas en las células de las aréolas de algunas leguminosas, por Endo y Ohashi (1998) y Perissé y Tourn (2015), la homogeneidad observada en las características citológicas muestra que en la superficie cotiledonar de H. cannabinus no se identifican zonas limitadas como las aréolas. Además, la tinción con TZ realizada para identificar aréolas en los cotiledones, respalda estos resultados, ya que el embrión mostró un patrón homogéneo en cuanto a la topografía y la coloración de la superficie del cotiledón externo, como se observa en la Figura 3 I. Endo y Ohashi (1998) y Perissé y Tourn (2015) mencionan que las aréolas son zonas especializadas en el transporte de sustancias de reservas (entre otras funciones). A partir de las observaciones en H. cannabinus, se podría inferir el rol activo de toda la superficie cotiledonar en el transporte de reservas y establecer relaciones con la morfología del embrión tales como: los cotiledones amplios, foliosos y plegados, el embrión curvo y la presencia de endosperma rodeándolo.
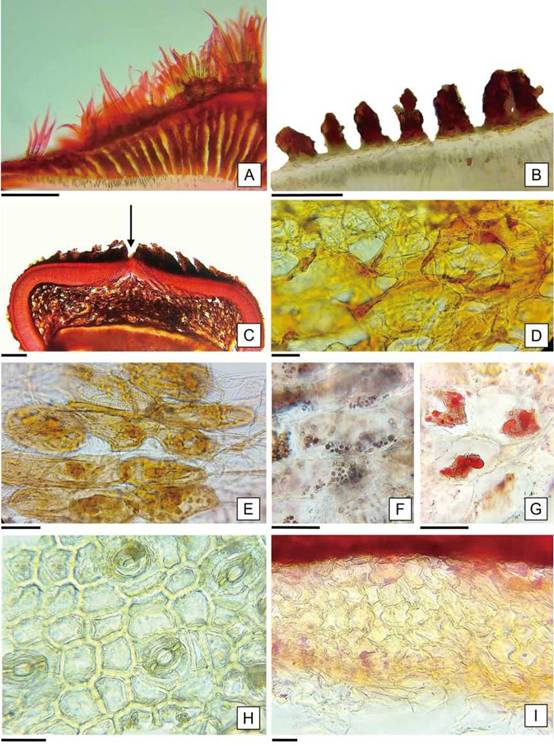
Figura 5: Anatomía del episperma de H. cannabinus en la zona de la cálaza. A: Corte transversal del estrato más externo mostrando tricomas comosos, columnas de células suberosas y cámaras de aire. B: Detalle de las columnas de células suberosas. C: Vista general del corte transversal del episperma, la flecha indica la interrupción de la capa de macroesclereidas. D: Detalle de la capa de células taníferas con aerénquima. E, F y G: Células en hileras radiales con contenidos pigmentados, almidón y lípidos, respectivamente. H: células moliniformes con estomas. I: Células de la cubierta que limita con el endosperma. Escalas= A-C:150 pm. D-I: 20 pm.
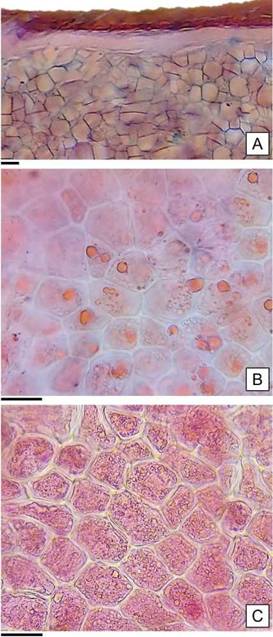
Figura 6: Anatomía del endosperma de H. cannabinus. A: Endosperma en transcorte, se observa la cubierta de células moliniformes y la capa blanca compacta indiferenciada. B: Lípidos en forma de gotas refringentes teñidas de color rojo. C: Endosperma con proteínas. Escalas= A, B y C: 30 pm.
Sin embargo, es necesario realizar observaciones durante el proceso de endospermogénesis y embriogénesis para analizar y confirmar la función de la epidermis cotiledonar en la absorción del endosperma.
En cuanto al mesofilo dorsiventral, está formado por un estrato de células de parénquima en empalizada y por siete a nueve capas de células de parénquima esponjoso (Figura 7 C). Además, se identificaron idioblastos cristalíferos (solitarios o a pares) en la zona media del mesofilo que dieron reacción positiva a la prueba de oxalato de calcio y sustancias de reserva en las células parenquimáticas que reaccionaron positivamente a la prueba histoquímica, como lípidos y proteínas (Figura 7 C-F).
Ajuste de la prueba de tetrazolioLa metodología propuesta de la prueba de tetrazolio para evaluar viabilidad en las semillas de H. cannabinus se presenta en la Tabla 2. En el apartado correspondiente a la preparación de la semilla previa a la imbibición, no se realizó ningún procedimiento. Si bien la escarificación es el paso inicial de la prueba de tetrazolio indicado para las semillas duras de Hibiscus por Moore (1985), se debe aclarar que H. cannabinus no está incluido entre las especies con dormición física mencionadas para el género por Baskin y Baskin (2014). Además, las características morfológicas observadas en el episperma de H. cannabinus, no concuerdan con los rasgos histológicos típicos de las semillas duras. Todas estas particularidades permiten prescindir de pasos previos a la imbibición de las semillas.
En relación al tiempo de imbibición, con 16 h a temperatura ambiente (20±3 °C) se logró una adecuada hidratación de las semillas que se evidenció al finalizar la prueba en la homogeneidad de la tinción de los distintos tejidos seminales. Este tiempo está dentro del período propuesto por Mc Carty y Baskin (1978) entre 12 y 18 h, mientras que Moore (1985), ISTA (2003) y AOSA (2010) propusieron períodos de entre 18 y 24 h.
En la preparación de la semilla posterior a la imbibición y previa a la tinción se observó que los cortes longitudinales realizados en los extremos de la semilla post imbibición, prolongaron los tiempos requeridos para la tinción (entre 18 a 24 h) con la consecuente germinación e invalidación del análisis. Otra técnica que se probó, consistente en practicar un corte longitudinal en la cara ventral del episperma, desde el extremo curvo de los cotiledones hacia el ápice de la radícula generó daños de las estructuras esenciales (cotiledones y radícula) y dificultó la posterior evaluación. Debido a estos resultados, los procedimientos propuestos por Moore (1985), ISTA (2003) y AOSA (2010) se descartaron. El método que resultó más apropiado consistió en la extracción de la cubierta seminal, ya que permitió concluir la prueba de tetrazolio (siguiente paso) antes de que ocurra la germinación y realizar una adecuada evaluación de los resultados en las estructuras seminales. Estos procedimientos coinciden con la metodología de Mc Carty y Baskin (1978) y con uno de los cuatro propuestos por Moore (1985).
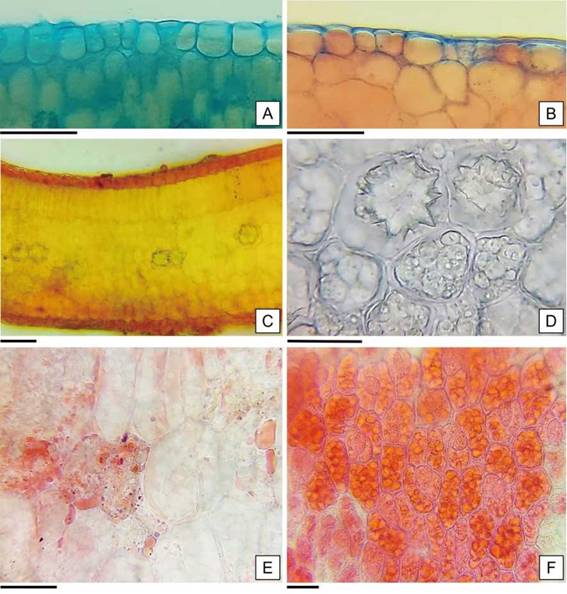
Figura 7: Anatomía de los cotiledones de H. cannabinus. A: Epidermis adaxial. B: Epidermis abaxial. C: Corte transversal por el cotiledón. D: Cristales inmersos en el mesofilo de los cotiledones. E: Lípidos en los cotiledones en forma de gotas rosadas refringentes. F: Cuerpos proteicos de color rojo ladrillo a rojo intenso en cotiledón. Escalas= A-F: 30 pm.
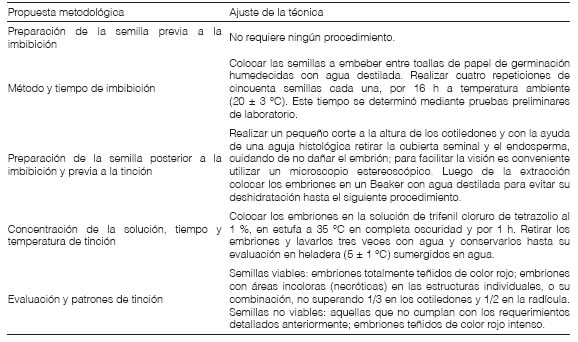
Tabla 2: Protocolo para la prueba de tetrazollo en semillas de H. cannabinus. Propuesta metodológica Ajuste de la técnica
En el apartado correspondiente a la concentración de la solución de TZ, el tiempo y la temperatura de tinción, los resultados obtenidos con la concentración del 1 % durante 1 h y la temperatura de 35 °C permitieron realizar evaluaciones concluyentes. Esto se debe a que en el procedimiento previo, se extrajo la cubierta seminal y el endosperma con lo cual se eliminaron las barreras físicas que reducirían la velocidad de ingreso de la solución de TZ, y en consecuencia el embrión se encuentra más expuesto al contacto directo con el TZ. Si bien en esta metodología, la concentración y temperatura coinciden con las prescripciones realizadas por Moore (1985), ISTA (2003), AOSA (2010) e ISTA (2021), en relación al tiempo, dichos autores, mencionaron mayor cantidad de horas (6 a 24 h).
En relación al análisis topográfico de los embriones de H. cannabinus, la vista externa de los tejidos seminales resultó ser la opción más adecuada y simple para ejecutar la práctica de evaluación por TZ. Si bien es ampliamente aceptado el criterio de que las técnicas de tetrazolio se basan en la visualización de las estructuras internas de las semillas, en especial los tejidos meristemáticos y circundantes al ápice radical y caulinar; esta especie presenta los cotiledones plegados entre sí en sentido longitudinal y envolviendo al eje radícula-hipocótilo lo que impide observar el ápice caulinar. Por otro lado, el ápice caulinar no está desarrollado, por lo tanto, la posibilidad de diseccionar el embrión implica desplegar los cotiledones para observar el ápice en estado rudimentario, lo que aumenta el riesgo de dañar las distintas estructuras seminales y de comprometer la evaluación.
En relación a la tinción de color rojo intenso observada en el extremo de la radícula en semillas viables de H. cannabinus, no se consideró como un perjuicio al momento de realizar la evaluación de los embriones. McCarty y Baskin (1978) observaron este mismo patrón de tinción en embriones de G. hirsutum, y lo atribuyeron al inicio de la actividad metabólica originada por el ingreso de agua en la semilla.
Los criterios del análisis topográfico de los embriones de H. cannabinus coinciden con los lineamientos de Mc Carty y Baskin (1978), Moore (1985), ISTA (2003) y AOSA (2010).
Las diferencias obtenidas en cada uno de los apartados de las propuestas de Mc Carty y Baskin (1978), Moore (1985), ISTA (2003) y AOSA (2010) y las adoptadas en la metodología ¡mplementada en H. cannabinus se atribuyen a que los desarrollos tomados como referencia están diseñados para otras especies de Hibiscus y contemplan generalidades que no se ajustan a las particularidades morfológicas de la semilla de H. cannabinus.
Implementación de la prueba de tetrazolio y clasificación de los embriones según su viabilidadLa prueba de tetrazolio no registró diferencias significativas entre los valores de viabilidad de ambos cultivares (p<0,05), tanto para semillas viables (‘Endora': 77,00 % ± 2,27; ‘Tainung 1': 74.00 °% ± 2,27), como en las no viables (‘Endora': 23.00 0% ± 2,27; ‘Tainung 1': 26,00 0% ± 2,27). Se pudo verificar con estas pruebas que la viabilidad de las semillas con treinta meses de almacenamiento fue superior al 70 %.
Se consideraron semillas viables a aquellas que presentaron el embrión uniformemente teñido de color rojo pálido o rosado y con tejidos de consistencia turgente (Figura 8 A). Asimismo, la Figura 8 B muestra un embrión con el eje radícula-hipocótilo completamente teñido y una pequeña área sin teñir en la zona distal del cotiledón y que no supera 1/3 del área total. Se observa además, el extremo de la radícula de color rojo intenso derivado de una mayor actividad metabólica de los tejidos. Aquellas semillas que presentaron menos de 1/2 de la radícula del embrión sin teñir (Figura 8 C) también fueron clasificadas como viables.
Dentro de la categoría de semillas no viables fueron incluidas aquellas semillas con 1/2 o más de la superficie radicular sin teñir (Figura 9 A); semillas con más de 1/3 del área cotiledonar sin teñir (Figura 9 B); embriones teñidos de rojo oscuro, signo de un deterioro avanzado por excesiva actividad meristemática (Figura 9 C); semillas con el área del nudo cotiledonar sin teñir (Figura 9 D), y embriones sin teñir en su totalidad (Figura 9 E).
Evaluación de la prueba de tetrazolioLas variables del ensayo de germinación no registraron diferencias entre ‘Endora' y ‘Tainung 1' (p<0,05) y no se observaron semillas frescas ni duras (Tabla 3). El porcentaje de plántulas normales de ‘Endora' fue 76,00 ± 1,17 y el de ‘Tainung 1' 72,75 ± 1,17. Al cotejar estos resultados con los de viabilidad obtenidos en la prueba de tetrazolio, las diferencias fueron 1,31 % para ‘Endora' y 1,70 % en ‘Tainung 1' y no se registraron diferencias (p<0,05). Según el criterio de Franga Neto et al. (1988), las diferencias entre los resultados de ambas pruebas fueron menores al 5 % en los dos cultivares, por lo tanto, se corroboró la confiabilidad del mismo. Los valores obtenidos de semillas viables y no viables se asemejan a los porcentajes de plántulas normales y anormales, respectivamente. De este modo, las semillas viables originaron plántulas normales, mientras que, en el caso de las plántulas anormales y semillas muertas del ensayo de germinación, se atribuyen a las semillas no viables de la prueba de tetrazolio. Además, se registró una correlación significativa y positiva (r = 0,75) entre ambas metodologías, por lo tanto, el Coeficiente de Correlación de Pearson, también evidenció la capacidad de la prueba de tetrazolio para expresar con exactitud y rapidez el potencial de germinación en semillas de H. cannabinus.
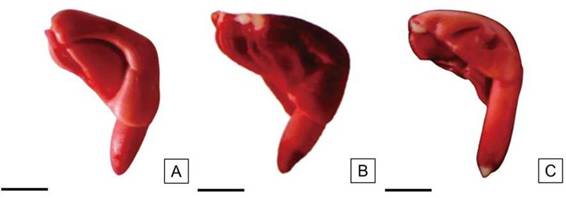
Figura 8: Embriones de H. cannabinus viables. A: Embrión teñido de rojo completamente. B: Embrión con menos de 1/3 de los cotiledones sin teñir. C: Embrión con menos de 1/2 de la radícula sin teñir. Escalas= A-C: 2,5 mm.

Tabla 3: Valores promedio y error estándar de plántulas normales y anormales y semillas frescas, duras y muertas, en dos cultivares de H. cannabinus. Letras iguales obtenidas por el test DGC, indican que no hay diferencias estadísticamente significativas entre las medias involucradas (p>0,05).
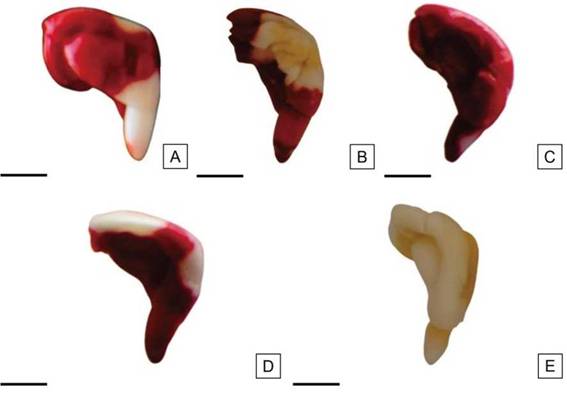
Figura 9: mbriones de H. cannabinus no viables, sin tinción en áreas consideradas esenciales. A: Embrión con radícula sin teñir. B: Embrión con más de 1/3 de los cotiledones sin teñir. C: Embrión teñido de color rojo oscuro. D: Zona del nudo cotiledonar sin teñir. E: Embrión sin teñir. Escalas= A-E: 2,5 mm.
Clasificación de las semillas según su vigorLas semillas de vigor alto fueron aquellas teñidas en toda su superficie de color rojo o rosado pálido y presentaron pequeñas áreas necróticas puntuales e incoloras en los cotiledones; el tejido evidenció una consistencia turgente y brillante sin signos de deterioro, el extremo de la radícula se tiñó adecuadamente (Figura 10). En esta categoría se obtuvieron los mayores valores (superiores al 61 %) (Tabla 4).
Las semillas con vigor medio registraron valores entre el 19% y 20%. Este grupo se caracterizó por presentar algunas porciones limitadas de los cotiledones sin teñir. El eje radícula-hipocótilo estuvo uniformemente teñido y con el extremo de la radícula con pequeñas áreas sin teñir. La consistencia del tejido fue firme y de color ligeramente más oscuro que las semillas de vigor alto (Figura 11).
Las semillas de vigor bajo fueron las de menor proporción en el lote de semillas. En esta categoría se observaron semillas con áreas incoloras de tamaño medio, aunque alejadas del eje radícula-hipocótilo. Los cotiledones presentaron una tinción rojiza más intensa respecto a las otras categorías y en algunos sitios tuvieron apariencia lechosa. Las áreas permitidas sin teñir no superaron 1/3 del área cotiledonar total (Figura 12). En algunos casos, se presentó el extremo de la radícula incolora (correspondiente a menos de 1/2 de la misma) y la consistencia de los tejidos flácida.

Tabla 4: Valores promedio y error estándar de vigor por TZ en dos cultivares de H. cannabinus. Letras iguales obtenidas por el test DGC, indican que no hay diferencias estadísticamente significativas entre las medias involucradas (p>0,05).
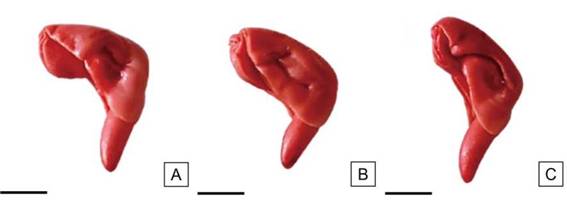
Figura. 10: Embriones de semillas de H. cannabinus teñidos homogéneamente en su mayor superficie. Vigor alto. Escalas= A-C: 2,5 mm.
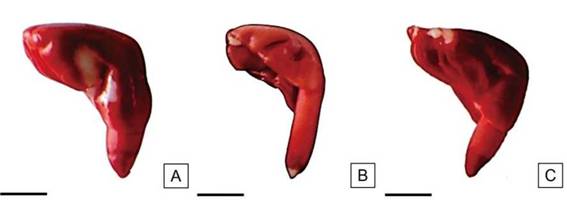
Figura 11: Embriones de semillas de H. cannabinus con pequeñas áreas sin tinción. Vigor medio. Escalas= A-C: 2,5 mm.
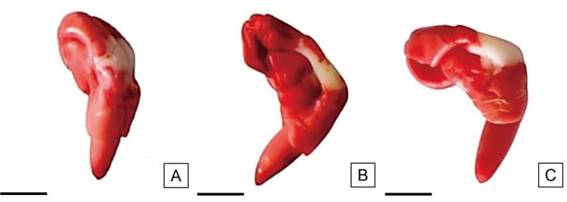
Figura 12: Embriones de semillas de H. cannabinus con grandes áreas sin tinción, límite de viabilidad. Vigor bajo. Escalas= A-C: 2,5mm.
No hubo diferencias entre los dos cultivares en los niveles de vigor alto y medio, mientras que sí se registraron diferencias significativas (p<0,05) para el nivel bajo (Tabla 4).
En esta clasificación los criterios coinciden con los aplicados por McCarty y Baskin (1978) en Gossypium hirsutum, ya que fueron interpretados y aplicados de manera directa debido a las similitudes morfológicas entre ambas semillas de la misma familia. Se destaca que, si bien ISTA (2021) aporta información valiosa en la descripción de la técnica de vigor por tetrazolio para clasificar semillas de Glycine max, estos criterios difieren con los que fueron utilizados para H. cannabinus, debido a las diferencias morfológicas entre ambas semillas.
CONCLUSIONES
La descripción detallada de las características morfológicas de la semilla de H. cannabinus y su interpretación desde la tecnología de semillas, constituyen aportes originales para esta especie poco estudiada desde la perspectiva de su calidad. Las observaciones del episperma, permiten explicar la contribución de los tricomas, esclereidas y los diferentes estratos celulares en el color y ornamentación de las semillas. Se comprueba la presencia de la tapa de imbibición sobre el istmo y se explica la relación estructura-función como válvula reguladora del ingreso de agua. Los estudios comparativos entre las semillas de los cultivares ‘Endora' y ‘Tainung 1' confirman que comparten las particularidades morfológicas cualitativas, mientras que según el análisis cuantitativo se pueden diferenciar por el peso de mil semillas y el ancho del embrión. Se aportan datos novedosos sobre las características citológicas de las estructuras reservantes, y se revela la importancia de los cotiledones foliosos como estructuras esenciales en la acumulación de lípidos y proteínas. Se necesitan estudios descriptivos de los procesos de endospermogénesis y embriogénesis que complementen y confirmen la información sobre la función nutricional de la epidermis de los cotiledones, el rol de la capa de células de paredes moniliformes y expliquen la presencia de los estomas en dicha capa.
En relación con la prueba de tetrazolio, los procedimientos existentes para otras especies de Hibiscus (incluso para otros géneros de Malvaceae) sirvieron de guía para establecer el protocolo de H. cannabinus. Sin embargo, las particularidades de la morfología de la semilla de esta especie determinaron metodologías específicas en el procedimiento de análisis y en el criterio de observación. El procedimiento de retirar la cubierta seminal antes de exponer las semillas a la solución de TZ, permite disminuir de manera notoria los tiempos empleados en el ensayo, mientras que las características morfológicas de difícil observación, como el embrión plegado, la plúmula rudimentaria y el eje radícula-hipocótilo, no se consideran para su evaluación. Los patrones de tinción permiten diferenciar las semillas por su viabilidad y posibilitan hacer una adecuada clasificación con tres categorías de vigor en los cultivares ‘Endora' y ‘Tainung 1'. Los ensayos de germinación confirman la factibilidad de la metodología propuesta para realizar la evaluación de viabilidad de las semillas de H. cannabinus. Los procedimientos empleados en la prueba bioquímica por tetrazolio para estimar viabilidad se presentan como una metodología apropiada y eficaz ya que permiten estimar el potencial de germinación y discriminar cultivares de H. cannabinus por su calidad.
AGRADECIMIENTOS
Los autores agradecen a los Laboratorios de Microscopía Óptica y de Análisis de Semillas (LASIDYS) de la Facultad de Ciencias Agropecuarias (UNC). A la Dra. Patricia Perissé por los aportes respecto a la lectura crítica del manuscrito y a los revisores anónimos por las sugerencias para mejorar el presente trabajo.
Fecha de recepción: 19/04/2023
fecha de aceptación: 06/03/2024.
BIBLIOGRAFÍA
Abid, R., Ather, A. y Qaiser, M. (2016). Seed morphology and its taxonomic significance in the family Malvaceae. Pakistan Journal of Botany, 48, 2307-2341.
Acreche, M., Gray, L. N., Collavino, N. y Mariotti, J. (2005). Effect of row spacing and lineal sowing density of kenaf (Hibiscus cannabinus L.) yield components in the North-West of Argentina. Spanish Journal of Agricultural Research, 3(1), 123-129. https://doi.org/10.5424/sjar/2005031-132
Association of Official Seed Analysts (AOSA, 2010). AOSA/ SCST. Tetrazolium Testing Handbook. Association of Official Seed Analysts.
Barthlott, W. (1981). Epidermal and seed surface characters of plants: systematic applicability and some evolutionary aspects. Nordic Journal of Botany, 1(3), 345-355. https://doi.org/10.1111/j.1756-1051.1981.tb00704.x
Baskin, J.M. y Baskin, C. C. (2014). Seeds Ecology, Biogeography, and Evolution of Dormancy and Germination (2 ed). Academic Press.
Boesewinkel, F.D. y Bouman, F. (1984). The seed: structure. En: B. M. Johri (Ed.), Embryology of Angiosperms (567-610). Springer.
Bornand, A. V. y Beltramini, V. S. (2021). Caracterización morfológica de la semilla de Hibiscus cannabinus (Malvaceae) e influencia del tiempo de almacenamiento sobre la viabilidad. Lilloa, 58(1), 5162. https://doi.org/10.30550/¡.lil/2021.58.1/2021.04.26
Córner, E.J.H. (2009). The Seeds of Dicotyledons. Cambridge University Press.
Delouche, J.C., Still, T.W., Raspet, M. y Lienhard, M. (1962). The tetrazolium test for seed viability. (Boletín Técnico 51). Mississippi, EEUU: Mississipi State University.
Di Rienzo, J. A., Casanoves, F., Balzarini, M.G., González, L., Tablada, M. y Robledo, C.W. (versión 2021). Software. Córdoba, Argentina: Centro ,de Transferencia Infostat, Facultad de Ciencias Agropecuarias, Universidad Nacional de Córdoba.
Endo, Y. y Ohashi, H. (1998). The features of cotyledon areoles in Leguminosae and their systematic utility. American Journal of Botany, 85, 753-759. https://doi. org/10.2307/2446409
Evert, R. F (2008). Esau Anatomía vegetal. Meristemas, células y tejidos de las plantas: su estructura, función y desarrollo (3a ed.). Omega.
Falasca, S. L., Ulberich, A. C. y Pitta-Alvarez, S. (2014). Possibilities for growing kenaf (Hibiscus cannabinus L.) in Argentina as biomass feedstock under dry-subhumid and semiarid climate conditions. Biomass and bioenergy, 64, 70-80. https://doi.org/10.1016/¡. biombioe.2014.03.031
Franga-Neto, J. B., Pereira, L. A. G., Costa, N. P., Krzyzanowski, F C. y Henning, A. A. (1988). Metodología do teste de tetrazólio em sementes de soja. Londrina: EMBRAPA-CNPSo.
Kirkbride, J.H. Jr., Gunn, C.R. y Weitzman, A.L. (2003). Fruits and seeds of genera in the subfamily Faboideae (Fabaceae). (Boletín técnico del Departamento de Agricultura de los Estados Unidos, N° 1890). Agricultural Research Service.
Martin, A. C. (1946). The comparative internal morphology of seeds. The American Midland Naturalist, 36, 513660.
McCarty, W. H. y Baskin, C. C. (1978). Cotton Seed Quality Evaluation. Seed Technology Papers, 29. Retrieved from https://scholarsjunction.msstate.edu/ seedtechpapers/29
Ministerio de Agricultura, Ganadería y Abastecimiento de Brasil. Secretaría de Defensa Agropecuaria (2009). Regras de Análise de Sementes. Assessoria de Comunicagao Social. Recuperado de: https:// www.gov.br/agricultura/pt-br/assuntos/insumos-agropecuarios/arquivos-publicacoes-insumos/2946regras analise sementes.pdf
Monti, A. y Alexopoulou, E. (2013). Kenaf: a multipurpose crop for several industrial applications. Springer Verlag. https://doi.org/10.1007/978-1-4471-5067-1
Moore, R. P. (1962). TZ checks your seed for quality. Crops and Soils, 15, 10-12.
Moore, R. P. (1985). Handbook on tetrazolium testing. International Seed Testing Association.
Moreira de Carvalho, N. y Nakagawa, J. (1988). Semillas: ciencia, tecnología y producción. Agropecuaria Hemisferio Sur.
Müssig, J. (Ed.) (2010). Industrial Applications of Natural Fibres Structure, Properties and Technical Applications. Wiley and Sons.
Olteanu, R. (1933). Etude monographique sur Hibiscus esculentus (Abelmoschus esculentus (L.) MEY.). Laupen-Berne: Société polygraphique.
Pascualides, A. L., Baigorria, M. C., Rinaldi, G. V., Buffa Menghi, M. N. y Bornand, A. V. (2013). Evaluación de dos fechas de siembra de Hibiscus cannabinus L. “kenaf” (Malvaceae) en Villa del Totoral, Córdoba, Argentina. Agronomía & Ambiente, 33(1-2), 31-42.
Perissé, P. y Tourn, G. M. (2015). Morfología de la semilla, presencia de aréolas y entrada de agua en la imbibición de Vicia dasycarpa Ten. cv. Tolse F.C.A. Phyton, 84(1), 184-189.
RAL. (2024). Colores RAL CLASSIC. Recuperado de: https://cartaral.es/pages/colores-ral Werker, E. (1997). Seed Anatomy. Gebrüder Borntraeger.
Winter, D. (1960). The development of the seed of Abutilon theophrasti. II Seed coat. American journal of botany, 47(3), 157-162. https://doi.org/10.1002/j.1537-2197.1960.tb07108.x
Zarlavsky, G. E. (2014). Histología Vegetal: Técnicas simples y complejas. Sociedad Argentina de Botánica.