Valoración del estado nutricional antes y después del tratamiento de quimioterapia en fase de inducción en niños y adolescentes con leucemia
Rosana Elizabeth Maidana1, María Agustina Bianciotti1, Gabriela del Valle Mori1, Gabriela Natalia Ávila Sabattini1, Nahuel Alejandro Ojeda1, Ricardo Daniel Vera1, Micaela Natalia Campero1,2, Verónica Mamondi1, Carlos Matias Scavuzzo1,2
1Escuela de Nutrición, Facultad de Ciencias Médicas, Universidad Nacional de Córdoba (UNC). Córdoba, Argentina.
2Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Buenos Aires, Argentina; Instituto de Altos Estudios Espaciales "Mario Gulich"; Comisión Nacional de Actividades Espaciales, CONAE-UNC, Córdoba Capital, Argentina.
Enviado: 14 de marzo de 2023.
Aceptado: 1 de junio de 2023.
Autora de correspondencia: Rosana Elizabeth Maidana. Contacto: rosana.maidana@unc.edu.ar.
Resumen
Objetivo: Analizar el estado nutricional antes y después de la fase de inducción del tratamiento quimioterápico en niños y adolescentes con leucemia linfoblástica aguda (LLA) y leucemia mieloide aguda (LMA) de 2 a 18 años atendidos en el Hospital de Niños de la Santísima Trinidad de Córdoba durante el periodo 2013-2016.
Métodos: Se realizó un análisis descriptivo, retrospectivo y longitudinal. La información se recopiló a partir de fuentes de información secundaria. La muestra incluyó 40 historias clínicas de individuos de entre 2 y 18 años de edad diagnosticados entre 2013 y 2016 con LLA y LMA.
Resultados: Antes de la fase de inducción, el estado nutricional antropométrico era normal en el 65% de la población, el 17,5% presentaba emaciación, el 7,5% desmedro y el 7% malnutrición por exceso. Además, el 95% presentaba una disminución de la hemoglobina y el 39,3% bajas concentraciones de albúmina. Tras la fase de inducción, el 72,5% ganó peso y el 22,5% lo perdió. No existieron diferencias del estado nutricional antropométrico en los niños que comenzaron con malnutrición por exceso y finalizaron la fase de inducción (p=0,046). Se observó una menor concentración de hemoglobina (90%) y de albúmina (35,7%) post inducción. Conclusión: Se observaron cambios en el peso en casi la totalidad de los niños y adolescentes tendiendo principalmente a su aumento.
Palabras claves: estado nutricional; oncología médica; pediatría.
ABSTRACT
Objective: To analyze the nutritional status before and after the induction phase of chemotherapy treatment in children and adolescents with acute lymphoblastic leukemia (ALL) and acute myeloid leukemia (AML) aged 2-18 years attended at the Hospital de Niños de la Santísima Trinidad de Córdoba during the period 2013-2016. Methods: A descriptive, retrospective and longitudinal analysis was performed. The information was collected from secondary information sources. The sample included 40 medical records of individuals aged 2-18 years diagnosed between 2013 and 2016 with ALL and AML.
Results: Before the induction phase, anthropometric nutritional status was normal in 65% of the population, 17.5% had failure to thrive, 7.5% had wasting and 7% had excess malnutrition. In addition, 95% had decreased hemoglobin and 39.3% had low albumin concentrations. After the induction phase, 72.5% gained weight and 22.5% lost weight. There were no differences in anthropometric nutritional status between children who started with excessive malnutrition and those who completed the induction phase (p=0.046). All those with excess malnutrition remained in this category until the end of the induction phase. These results were statistically significant (p=0.046). A lower hemoglobin (90%) and albumin (35.7%) concentration was observed post induction.
Conclusion: Changes in weight were observed in almost all children and adolescents, tending mainly to an increase.
Keywords: nutritional status;
medical oncology; pediatrics.
Introducción
El cáncer infantil agrupa a las enfermedades caracterizadas por una proliferación celular anómala que afecta a la infancia. Según la Organización Mundial de la Salud (OMS) (1), aproximadamente 400.000 niños de 0 a 19 años desarrollan cáncer en todo el mundo, siendo una de las principales causas de mortalidad en la infancia y la adolescencia.
En pediatría hay dos grandes grupos de neoplasias: las hematológicas (leucemias y linfomas) y los tumores sólidos (2). El Registro Oncopediátrico Hospitalario Argentino (ROHA) (3), entre los años 2000 y 2019, reportó 27.016 casos de cáncer en niños menores de 15 años de edad y 4099 entre 15 y 19 años. Este mismo registro detalla que los cánceres más frecuentes en menores de 15 años en la provincia de Córdoba fueron las leucemias (34,4%), los linfomas (11,9%) y los tumores del sistema nervioso central (17,3%).
Entre las leucemias, encontramos la leucemia linfoblástica aguda (LLA), la más frecuente en la infancia, representando el 30% de todas las neoplasias; y la menos frecuente y con menor tasa de supervivencia, la leucemia mieloide aguda (LMA) (4). A su vez, la prevalencia de cáncer infantil muestra un predominio en los varones (56%) por sobre las mujeres (44%) (2).
El tratamiento quimioterápico de las leucemias se divide generalmente en una primera fase denominada inducción de la remisión, la cual dura cuatro semanas y tiene como objetivo inducir una remisión completa. Los niños con LLA de riesgo estándar reciben tres fármacos durante el primer mes de tratamiento. Estos incluyen L-asparaginasa, vincristina y un fármaco esteroide, normalmente dexametasonapara los niños de los grupos de alto riesgo, se suele añadir, generalmente, daunorubicina(5). En la LMA, los fármacos más utilizados son la daunorubicina y la citarabina y no se especifica el uso de fármacos esteroides en la fase de inducción (6) . La siguiente fase del tratamiento es la post inducción y se divide, en la terapia de consolidación y la terapia de mantenimiento que implica la continuación del tratamiento, con una duración total de 2 años (7).
El uso de quimioterapia conlleva una serie de efectos secundarios, ya que no sólo produce su impacto sobre las células tumorales, sino también sobre los tejidos sanos (8). Entre los efectos secundarios más comunes se encuentran la fatiga física, emocional o mental, la caída del cabello, los dolores articulares, el aumento de la susceptibilidad a las infecciones, la mucositis, la constipación, la diarrea, las náuseas, los vómitos y la pérdida de apetito. Estos tres últimos, si se prolongan, conducen a la pérdida de peso que conlleva a la desnutrición con pérdida de masa y fuerza muscular (9,10).
La desnutrición es la consecuencia más frecuente en los pacientes con cáncer y se considera un factor de predicción de la sobrevida del niño, ya que se ha asociado a una mayor resistencia a la quimioterapia y a un aumento de la mortalidad (11-13). Por lo tanto, en el momento del diagnóstico de la enfermedad, debe realizarse una evaluación nutricional completa que incluya parámetros antropométricos y bioquímicos, lo que permitirá establecer un tratamiento nutricional adecuado. A nivel antropométrico el peso y la talla son un medio preciso, rápido y reproducible de evaluación nutricional. Dentro de los bioquímicos, la albúmina sérica es poco sensible a los cambios recientes del estado nutricional, pero tiene un alto valor predictivo de las complicaciones asociadas a la desnutrición (14,15).
De acuerdo a lo expuesto, el objetivo de este estudio fue analizar el estado nutricional antes y después de someterse a la fase de inducción del tratamiento quimioterápico, así como valorar la presencia o ausencia de síntomas digestivos y el cambio de peso aparejado, de los niños y adolescentes con LLA y LMA de 2 a 18 años de edad asistidos en el Hospital de Niños de la Santísima Trinidad de la provincia de Córdoba, durante el periodo 2013-2016.
Metodología
Se realizó un estudio descriptivo, retrospectivo y longitudinal. La recolección de datos se llevó a cabo únicamente extrayendo información de historias clínicas.
Se incluyeron niños y adolescentes de ambos sexos de 2 a 18 años con diagnóstico de LLA y LMA que fueron atendidos en el Hospital de Niños de la Santísima Trinidad de la provincia de Córdoba en el periodo 2013-2016. La muestra se extrajo mediante un muestreo no probabilístico por conveniencia y estuvo conformada por 40 historias clínicas de niños y adolescentes que cumplieran con los criterios de inclusión.
Los criterios de inclusión fueron los siguientes: ser diagnosticados con LLA o LMA, no tener otra patología asociada y que hayan iniciado y completado la fase de inducción del tratamiento quimioterápico en el Hospital de Niños de la Santísima Trinidad de la provincia de Córdoba.
Se extrajeron de las historias clínicas, datos antropométricos (peso, talla e IMC) y bioquímicos (concentración de albúmina y hemoglobina en sangre) en el momento del diagnóstico oncológico y tras la fase de inducción, así como la presencia o ausencia de síntomas digestivos durante la fase de inducción. Se evaluó el estado nutricional antropométrico considerando para menores de 5 años las siguientes categorías: desmedro más emaciación (Peso/Talla P<15 y Talla/Edad P<15), desmedro (Peso/Talla P15-97, Talla/Edad P<15), emaciación (Peso/Talla P<15 y Talla/Edad P>15), normal (Peso/Talla P15-97 y Talla/Edad P>15), sobrepeso (Peso/Talla P97-99) y obesidad (Peso/Talla P>99). En el caso de niños mayores de 5 años se consideraron las siguientes categorías: desmedro más emaciación (IMC P<15 y Talla/Edad P<15), desmedro (IMC P15-97 y Talla/Edad P15), emaciación (IMC P<15 y Talla/Edad P<15), normal (IMC P15-97 y Talla/Edad P>15), sobrepeso (IMC P97-99) y obesidad (IMC P>99) En todos los casos se tomó como referencia los patrones de crecimiento infantil de la OMS considerando percentiles y utilizando el software Who Anthro y Who Anthro Plus ambos versión 3.1.0 para facilitar la aplicación de dichos estándares.
Análisis estadístico
La unidad mínima básica de análisis fue a nivel individual. Se realizó un análisis descriptivo con medidas resumen acorde a la naturaleza de cada variable.Se analizó mediante T-Student si existen diferencias del estado nutricional antropométrico antes y después del tratamiento de fase de inducción, y mediante el test McNemar si existen diferencias en el cambio de peso entre los niños que tuvieron sintomatología digestiva tras la fase de inducción y quienes no las presentaron. Se trabajó con un nivel de confianza al 95% de los test utilizados. Se empleó el software IBM SpSS versión 2016 para el procesamiento de datos.
Aspectos éticos
La recolección de datos se realizó a partir de la información contenida en las historias clínicas, de acuerdo al principio ético de Respeto por las Personas y a La Ley Nacional 25.326 de Protección de Datos Personales.
Resultados
Caracterización de la muestra
Las características de la población se resumen en la Tabla Nº1. Los resultados reflejaron que las leucemias se expresaron en mayor medida en el sexo masculino y la edad media de presentación fue de 5 años. El diagnóstico de mayor prevalencia fue LLA.
Tabla Nº1. Características de la población estudiada del Hospital de Niños de la Santísima Trinidad de la provincia de Córdoba
|
Total (n) |
40 |
|
Sexo |
|
|
Masculino; n (%) Femenino: n (%) |
22 (55%) 18 (45%) |
|
Edad |
|
|
Preescolar: n (%) Escolar: n (%) Adolescencia: n (%) |
23 (57,5%) 9 (22,5%) 8 (20%) |
|
Diagnóstico oncológico |
|
|
LLA: n (%) LMA: n (%) |
36 (90%) 4 (10%) |
Estado nutricional antropométrico antes y después de la fase de inducción
La Figura Nº1 muestra el estado nutricional antropométrico que presentó la población estudiada antes y después de la fase de inducción.
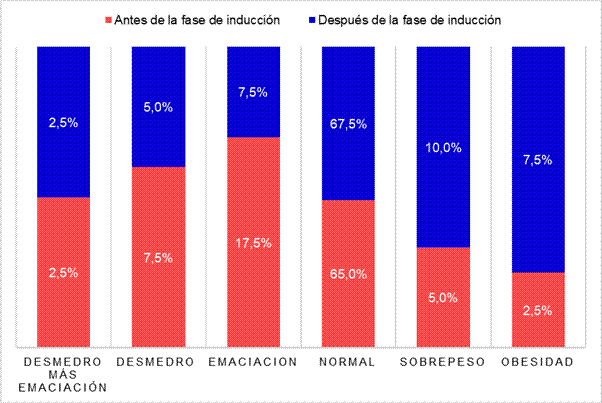
Figura Nº1. Estado nutricional antes y después de la fase de inducción de los niños y adolescentes (N=40) del Hospital de Niños de la Santísima Trinidad de la provincia de Córdoba en el periodo 2013-2016.
Por otra parte, en la Figura Nº2 se expresan los cambios en el estado nutricional antropométrico y compara los mismos. En el momento del diagnóstico más de la mitad de los pacientes tuvieron un estado nutricional normal y, en su mayoría, se mantuvieron en dicho estado nutricional luego de la fase de inducción (88,5%) siendo sólo un pequeño porcentaje (11,5%) el que modificó su estado nutricional normal a malnutrición por exceso después del tratamiento quimioterápico (sobrepeso y obesidad).
La malnutrición por exceso se presentó en el 7,5% de los niños al momento del diagnóstico y, la totalidad de ellos mantuvieron dicha categoría hasta finalizar la fase de inducción. Con un 95% de confianza se puede afirmar que se mantuvo esa proporción antes y después del tratamiento (p=0,046).
Finalmente se observó que la malnutrición por déficit representada por el desmedro, la emaciación y la combinación de ambos cuadros (desmedro más emaciación) se manifestó en el 27,5% de los pacientes. Luego de la fase de inducción la gran mayoría se encontró en la misma categoría, una menor proporción modificó su estado nutricional a normal (36,4%) y otro grupo a malnutrición por exceso (9,1%).
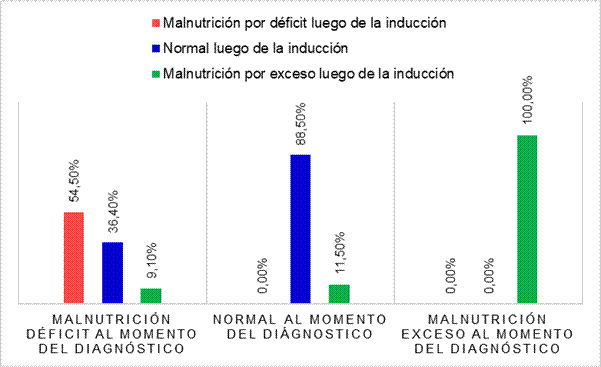
Figura Nº2. Comparación de los cambios del estado nutricional antropométrico al momento del diagnóstico oncológico y al finalizar la fase de inducción de los niños y adolescentes (N=40) del Hospital de Niños de la Santísima Trinidad de la provincia de Córdoba en el periodo 2013-2016
Estado nutricional bioquímico antes y después de la fase de inducción
La mayoría presentó valores disminuidos de hemoglobina al momento de diagnóstico y un pequeño porcentaje se encontró con valores normales. Luego de la fase de inducción un grupo logró normalizar sus valores. La concentración de albúmina al momento del diagnóstico solo se registró en las historias clínicas de 28 pacientes. A diferencia de la hemoglobina, la mayoría presentó concentraciones de albúmina normales y al finalizar la fase de inducción la proporción aumentó (Figura Nº3).
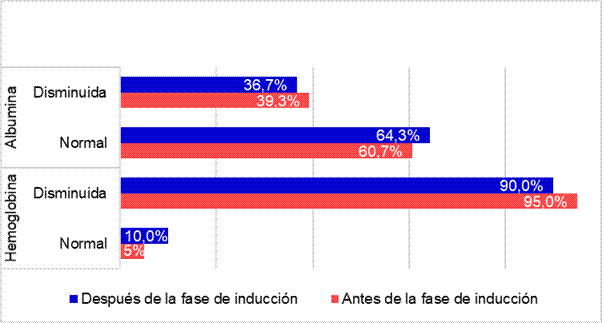
Figura Nº3. Comparación de la concentración de hemoglobina (N=40) y albúmina (N=28) antes y después de la fase de inducción de los niños y adolescentes del Hospital de Niños de la Santísima Trinidad de la provincia de Córdoba en el periodo 2013-2016
Síntomas digestivos durante la fase de inducción
Durante el tratamiento quimioterápico de fase de inducción sólo se pudo corroborar en un total de 33 pacientes la presencia o ausencia de síntomas digestivos tales como diarrea, vómitos, náuseas, mucositis o constipación. El 61% presentó alguna de la sintomatología nombrada anteriormente, mientras que en el 39% estuvieron ausentes.
Cambios de peso antes y después de la fase de inducción
En relación a los cambios de peso 38 pacientes tuvieron variaciones del mismo desde su diagnóstico hasta la finalización de la fase de inducción (95%) y solamente dos no sufrieron ninguna modificación (5%). La mayor parte de la muestra tuvo un aumento de peso al finalizar la fase de inducción (72,5%) mientras que un número menor disminuyó su peso (22,5%). La media registrada de pérdida de peso fue de 3,38 kg y el aumento de peso promedio fue de 2,18 kg.
Cambios de peso según la presencia o ausencia de síntomas digestivos
Los niños que presentaron síntomas digestivos durante la fase de inducción tuvieron un menor aumento de peso, con un promedio de 1,878 kg en comparación con aquellos que no presentaron síntomas, con un aumento de 3,100 kg en promedio. Se obtuvieron dos casos sin cambios en el peso independientemente de los síntomas digestivos. Estos resultados a pesar de demostrar una relación entre los datos en esta investigación, resultan no estadísticamente significativos ya que el valor p fue de 0,08. No obstante, este valor presenta tendencia a la significancia y con un tamaño de muestra mayor la asociación podría ser significativa, lo cual hace considerable para el resto de los análisis.
En cuanto a los niños que tuvieron una disminución de peso luego de la fase de inducción, aquellos que presentaron síntomas digestivos, disminuyeron un promedio de 6,43 kg, mientras que en quienes se ausentaron los síntomas, no tuvieron una disminución importante de peso, con un promedio de 0,8 kg. Estos resultados no fueron estadísticamente significativos debido a que el valor de p fue 0,24).
Discusión
La prevalencia de leucemia en el presente estudio fue similar a las encontradas en la bibliografía. Una investigación de la Secretaría Seccional de Salud y Protección Social del Hospital General de Medellín Colombia (16) sobre la incidencia y mortalidad de las leucemias agudas pediátricas durante el periodo 2005-2010 mostró que la LLA representa alrededor del 77% de los casos y la LMA alrededor del 11%. Las mismas, tienen un pico de incidencia entre los 2 y 3 años, presentándose más en varones que en mujeres. Un estudio epidemiológico en México encontró que la LMA es el segundo tipo de leucemia más frecuente en la infancia. Hubo un predominio de pacientes masculinos (57,1%) y la edad media de aparición fue de 7 años (10,11). Amaru Ricardo et al (17) reafirman la distribución detallada anteriormente y encontrada en nuestra investigación. En su estudio, la LLA estuvo presente en el 79% de los menores de 18 años y la LMA en el 19% de los mismos. Los resultados obtenidos en nuestra investigación reflejan distribuciones similares.
Un estudio sobre estado nutricional y los resultados clínicos en niños con LLA realizado en Brasil mostró que la mayoría presentaba un estado nutricional normal (57,4%) mientras que un menor porcentaje presentó sobrepeso (16,7%) u obesidad (5,5%). El bajo peso estuvo presente en un 20,4% (18). Por otra parte, en Chile, se estudió 19 niños LLA y 2 niños con LMA menores de 18 años, concluyendo que en el momento del diagnóstico todos tuvieron un estado nutricional normal (expresado como P/T en percentiles) (19). Nuestros resultados fueron similares. Luego de la fase de inducción, comparamos los resultados con un estudio llevado a cabo en el Instituto Nacional de Cancerología de Bogotá-Colombia (20), que observó que un 23% de niños se encontraban con malnutrición por déficit al momento del ingreso de la quimioterapia y que, en el transcurso de la misma, ésta se incrementó (41%).
La disminución de la concentración de hemoglobina es un hallazgo frecuente en las leucemias. Puede estar presente en el momento del diagnóstico o ser una consecuencia de las terapias utilizadas (21-23). La Sociedad Española de Pediatría (24) afirma que, en la mayoría de los pacientes, la realización de un hemograma confirma las sospechas de la enfermedad donde se encuentra leucocitosis a expensas de linfoblastos (50%), disminución de la concentración de hemoglobina (80%) y trombopenia (75%). El Servicio de Pediatría del Hospital Universitario Mútua Terrassa de Barcelona-España (25), estableció que la disminución de la concentración de hemoglobina se produce en el 80% de los casos en la LLA y en el 50% en la LMA. Estos hallazgos coinciden con los de nuestro estudio.
En cuanto al indicador de albúmina, en nuestro estudio se observó que la mayoría de los pacientes al momento del diagnóstico tenían concentraciones normales, lo que coincide con un estudio realizado en Turquía (26). Sin embargo, difieren de otros estudios, uno realizado por el Departamento de Pediatría del Hospital de Especialidades del Instituto Mexicano del Seguro Social en Monterrey (27) que incluyó a 21 niños con LLA quienes presentaron hipoalbuminemia al momento del diagnóstico y otro realizado en Estados Unidos donde los hallazgos son similares (28). La valoración nutricional bioquímica según la concentración de albúmina en sangre, es importante realizarla en el momento del diagnóstico ya que es predictor de complicaciones asociadas a la desnutrición del paciente.
La quimioterapia puede disminuir la motilidad intestinal, lo que dificulta la evacuación de las heces, como así también puede aumentar la frecuencia de las deposiciones y favorecer la diarrea. Asimismo, los fármacos utilizados pueden cambiar el sentido del gusto y el olfato en pacientes o generar náuseas y/o vómitos. La sintomatología digestiva asociada al tratamiento oncológico puede favorecer la inapetencia y conllevar a la pérdida de peso (29). En Brasil una muestra de 54 niños presentó síntomas con impacto directo en la ingesta de alimentos durante el tratamiento quimioterápico al igual que en los niños de nuestro estudio. Las alteraciones gastrointestinales más prevalentes fueron: mucositis (74,1%), vómitos (64,8%), náuseas (63,0%), diarrea (38,9%) y dolor abdominal (33,3%) (18).
En cuanto al cambio de peso durante la fase de inducción, el estudio en Chile mostró que los niños con LLA aumentaron 2,0 kg en promedio, mientras que los diagnosticados con LMA en general, tendieron al descenso de peso (19). La mayor parte de nuestra población presentaba como diagnóstico LLA y las variaciones de peso respondieron en gran medida al aumento del mismo. Las leucemias linfoblásticas reciben corticosteroides como parte de su tratamiento, las leucemias mieloides no, produciendo un marcado aumento del apetito acompañado de un incremento de la ingesta provocando en algunos pacientes aumento de peso a pesar del efecto catabólico que tienen sobre el metabolismo (30,31).
Como ventajas del estudio se remarca que el uso de historias clínicas facilitó la inmediatez de los datos antropométricos y bioquímicos para establecer las variables. En cuanto a las limitaciones del estudio se considera que el limitado tamaño muestral no permite la generalización de resultados. Consideramos que la presente investigación es un gran aporte para la epidemiología local, aportando elementos valiosos para mejorar las intervenciones nutricionales en el área oncohematológica pediátrica y de esta forma mejorar el pronóstico de estos pacientes.
Conclusión
La mayor proporción de pacientes tendió a la ganancia de peso luego del tratamiento quimioterápico de fase de inducción. Aquellos que al momento del diagnóstico presentaron un estado nutricional normal, conservaron el mismo o tendieron al sobrepeso y obesidad al finalizar el tratamiento, mientras que la totalidad de los pacientes que comenzaron con malnutrición por exceso se mantuvieron en dicha categoría. Además, se observó que más de la mitad de los casos que comenzaron el tratamiento con malnutrición por déficit no presentaron modificaciones en cuanto a su estado nutricional.
Agradecimientos
Queremos agradecer en especial a Gabriel David Torres y a la Mgter. Carola Hunziker por su colaboración a lo largo del proceso de desarrollo del presente trabajo.
Referencias bibliográficas
- Steliarova-Foucher E, Colombet M, Ries LAG, et al. International incidence of childhood cancer, 2001-10: a population-based registry study. Lancet Oncol [Internet]. 2017;18(6):719-731. http://doi.org/10.1016/S1470-2045(17)30186-9
- Pan American Health Organization (PAHO). Early Diagnosis of Childhood Cancer. Washington, DC:PAHO, 2014. [Internet]. [Consultado 3 Dic 2022]. Disponible en: https://iris.paho.org/handle/10665.2/34850
- Moreno, MF. Registro Oncopediátrico Hospitalario Argentino Resultados 2000-2019. Ciudad Autónoma de Buenos Aires, 2021. [Internet]. [Consultado 3 Dic 2022]. Disponible en: https://bancos.salud.gob.ar/recurso/registro-oncopediatrico-argentino-resultados-2000-2019
- Cárdenas Estrella SJ, Torres Celi AJ, Medina Suescun CJ, Quezada Cevallos AK Las enfermedades hematológicas en pediatría. Una revisión. RECIAMUC. [Internet]. 2023;7(1):40-51. https://doi.org/10.26820/reciamuc/7.(1).enero.2023.40-51
- Möricke A, Zimmermann M, Reiter A, Henze G et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia. [Internet]. 2009;24(2):265-84. http://doi.org/10.1038/leu.2009.257
- Rubnitz JE, Kaspers, GJ. How I treat pediatric acute myeloid leukemia. Blood. [Internet]. 2021;138(12):1009-1018. https://doi.org/10.1182/blood.2021011694
- Halfon-Domenech C. Leucemia linfoblástica aguda del niño y el adolescente. EMC Pediatr. [Internet]. 2021;56(1):1-9. http://doi.org/10.1016/S1245-1789(21)44720-7
- Smith MA, Altekruse SF, Adamson PC, Reaman GH, Seibel NL. Declining Childhood and Adolescent Cancer Mortality. Cancer. [Internet]. 2014; 120(16):2497-2506. http://doi.org/10.1002/cncr.28748
- Ferreiro J, García JL, Barceló R, Rubio I. Quimioterapia: efectos secundarios. Gac. Méd. Bilbao. [Internet]. 2003;100(2):69-74. https://doi.org/10.1016/S0304-4858(03)74432-1
- Reilly JJ, Weir J, McColl JH, Gibson BE. Prevalence of protein-energy malnutrition at diagnosis in children with acute lymphoblastic leukemia. J Pediatr Gastroenterol Nutr. [Internet]. 1999;29(2):194-7. http://doi.org/10.1097/00005176-199908000-00017
- Iniesta RR, Paciarotti I, Brougham MF, McKenzie JM, Wilson DC. Effects of pediatric cancer and its treatment on nutritional status: a systematic review. Nutrition reviews. [Internet]. 2015;73(5):276-295. https://doi.org/10.1093/nutrit/ nuu062
- Sala A, Rossi E, Antillon F, et al Nutritional status at diagnosis is related to clinical outcomes in children and adolescents with cancer: a perspective from Central America. Eur J Cancer. [internet]. 2012;48(2):243-52. https://doi.org/10.1016/j.ejca.2011.06.006.
- Joffe L, Ladas EJ. Nutrition during childhood cancer treatment: current understanding and a path for future research. The Lancet Child & Adolescent Health. [Internet] 2020;4(6):465-475. Disponible en: https://doi.org/10.1016/S2352-4642(19)30407-9
- Diakatou, V, Vassilakou T. Nutritional Status of Pediatric Cancer Patients at Diagnosis and Correlations with Treatment, Clinical Outcome and the Long-Term Growth and Health of Survivors. Children. [Internet]. 2020;7(11):218. http://doi.org/10.3390/children7110218
- Yaprak, DS, Yalçın, B, Pınar, AA, Büyükpamukçu, M. Assessment of nutritional status in children with cancer: Significance of arm anthropometry and serum visceral proteins. Pediatr Blood Cancer. [Internet]. 2020;68(1):28752. Disponible en: https://doi.org/10.1002/pbc.28752
- Palacios Barahona AU, Quirós Arango HM, Fabra Arrieta JC, Restrepo Carmona JA, Carvajal Gallo MA. Incidencia y mortalidad de las leucemias agudas pediátricas en Antioquia durante el periodo 2005-2010. Universidad Cooperativa de Colombia, Medellín y Envigado. [Internet]. 2011. [Consultado 12 Ene 2023]. 38(1). http://hdl.handle.net/20.500.12494/13721
- Amaru, R, Torres, G, Peñaloza, R, Miguez, H, et al. Epidemiología de las leucemias en Bolivia: 1473 casos de enero 1999 a mayo de 2012. Rev. Méd. La Paz. [Internet]. 2012;18(1):9-19. http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S1726-89582012000100003&lng=es&nrm=iso
- Carvalho ALM, Schramm MT, Murad LB, Saraiva DCA. Estado nutricional e desfechos clínicos em pacientes pediátricos com leucemia linfoblástica aguda. Rev. Bras. Cancerol. [Internet]. 2016;62(4):329-336. https://doi.org/10.32635/2176-9745.RBC.2016v62n4.160
- Bustos P, Joannon P, Radrigán ME. Evaluación nutricional de pacientes pediátricos oncológicos. Rev. chil pediatr. [Internet]. 1983;54(6):391-396. http://doi.org/10.4067/S0370-41061983000600001
- Anzola Perez DC. Estado nutricional en niños con leucemia linfoblástica aguda en el Instituto Nacional de Cancerología de Bogotá-Colombia 2007-2011. Universidad de la Sabana, Bogotá. [Internet]. 2012. [Consultado 12 Ene 2023]. 63(1). http://hdl.handle.net/10818/3685
- Onostre Guerra RD, Sardinas Castellon S, Riveros Morón A, Álvarez Endara J, y col. Diagnóstico temprano de leucemia aguda en niños y adolescentes. Rev. Soc. Bol. Ped. [Internet]. 2015;54(2):110-5. http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S1024-06752015000200010&lng=es&nrm=iso
- Becker AK. Interpretación del hemograma. Rev chil pediatr. [Internet]. 2001;72(5):460-465. http://doi.org/10.4067/S0370-41062001000500012
- Ortega M, Osnaya M, Rosas J. Leucemia linfoblástica aguda. Med Int Mex. [Internet]. 2007;23(1):26-33. https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=18287
- Lassaletta Atienza A. Leucemias. Leucemia linfoblástica aguda. Pediatr Integ. [Internet]. 2016;20(6):380-389. https://www.pediatriaintegral.es/publicacion-2016-07/leucemias-leucemia-linfoblastica-aguda-2016-07/
- García Bernal M, Badell Serra I. Leucemia en la infancia: signos de alerta. An Pediatr Contin. [Internet]. 2012;10(1):1-7. http://doi.org/10.1016/S1696-2818(12)70058-6
- Yu LC, Kuvibidila S, Ducos R, Warrier RP. Nutritional status of children with leukemia. Med Pediatr Oncol. [Internet]. 1994;22(2):73-77. https://doi.org/10.1002/mpo.2950220202
- Dávila-Rodríguez MI, Novelo-Huerta HI, Márquez-Solís R, Cortés-Gutiérrez E, et al. Indicadores nutricionales en niños con leucemia linfoblástica aguda. Rev. Med. Inst. Mex. Seguro Soc. [Internet]. 2010;48(6):639-644. https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=37436
- Bodánszky HE. Nutrition and pediatric cancer. Annals of the New York Academy of Sciences. [Internet].1997;824(1):205-209. http://doi.org/10.1111/j.1749-6632.1997.tb46223.x
- Díaz-Morales K, Reyes-Arvizu J, Morgado-Nájera K, Everardo-Domínguez DM. Síntomas en niños con cáncer y estrategias de cuidado familiar. Rev. Cuid. [Internet]. 2019;10(1):597. https://doi.org/10.15649/cuidarte.v10i1.597
- Vargas PL. Cáncer en pediatría: Aspectos generales. Rev. chil pediatr. [Internet]. 2000;71(4):283-295. https://doi.org/10.4067/S0370-41062000000400002
- Vergara Dominguez B, Swatch Guerlhicoff E, Gonzales Otero A, Machín García S, y col. Leucemia linfoblástica aguda infantil. Seguimiento post-finalización del tratamiento en 430 pacientes. Rev. Esp. Pediatr. [Internet]. 2004;60(5):348-355. https://pesquisa.bvsalud.org/portal/resource/pt/ibc-37759